
2、在 0.1 mol/L Na2CO3溶液中,下列关系正确的是(C)
A.c(Na+) = 2c(CO32-) B.c(OH-) = 2c(H+)
C.c(HCO3-) > c(H2CO3) D.c(Na+) <(c(CO32-)+c(HCO3-) )
1、关于小苏打水溶液的表述正确的是 (AD)
A.c(Na+) = c(HCO3-)+ c(CO32-)+ c(H2CO3)
B.c(Na+) + c(H+)= c(HCO3-)+ c(CO32-)+ c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
D.存在的电离有:NaHCO3 == Na+ + HCO3-,HCO3- 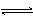 H+ +
CO32-,H2O
H+ +
CO32-,H2O
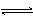 H+ +
OH-
H+ +
OH-
6、水解原理的应用:请用必要的文字和化学方程式或离子方程式解释下列事实:
(1)使用明矾净水:
(2)用热的纯碱溶液洗去油污:
(3)实验室将饱和氯化铁溶液滴入沸水,制备Fe(OH)3胶体:
(4)配制CuSO4溶液时,用冷水溶解并加入少量稀硫酸:
(5)泡沫灭火器原理:
(6)铵盐不宜和草木灰(K2CO3)混合使用:
(7)焊接时用NH4Cl溶液除锈:
(8)NaOH与CH3COOH恰好反应后溶液呈碱性:
考点二:溶液中的离子浓度比较
专题练习二:
物料守恒:
请写出浓度均为0.1 mol/L苏打、小苏打溶液中存在的物料守恒:
电荷守恒:
请写出苏打、小苏打溶液中存在的电荷守恒:
5、某同学设计了如下实验探究盐的水解反应规律。
(1)向碳酸钠溶液中滴入几滴酚酞试液,溶液呈红色,用离子方程式表示其原因:CO32-+H2O
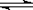 HCO3- + OH-
HCO3- + OH-
(2)用pH试纸测得硫酸铝溶液的pH为3,用离子方程式表示硫酸铝溶液呈酸性的原因:Al3+ +
3H2O 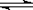 Al(OH)3 + 3H+;
Al(OH)3 + 3H+;
简述测定溶液的pH的操作方法是:用玻璃棒蘸取硫酸铝溶液,滴在pH试纸上,在与标准比色卡对比,读出读数。
(3)将硫酸铝溶液和碳酸钠溶液混合,可观察到的现象是生成无色气体和絮状沉淀,写出该反应的离子方程式: 2Al3+ + 3CO32-+3H2O = 2Al(OH)3↓ + 3CO2↑。
3、下列溶液中,CH3COO-离子的浓度最大的是 ( D )
A.0.1 mol·L-1的CH3COOH溶液 B.0.01 mol·L-1的CH3COOH溶液
C.0.1 mol·L-1的CH3COONH4溶液 D.0.1 mol·L-1的CH3COONa溶液
4、将0.01 mol下列物质置于1 L水中充分搅拌后,溶液中阳离子数最多的是
A.KCl B.NH4Cl C.AlCl3 D.Ca3(PO4)2 ( C )
2、溶液中溶质的物质的量浓度均为0.1 mol·L-1的下列溶液中,NH4+浓度最大的是 ( B )
A.NH4Cl B.NH4HSO4 C.CH3COONH4 D.氨水
1、判断下列溶液的酸碱性,并用必要的离子方程式加以说明:
(1)NaCl
(2)NH4Cl
(3)CH3COONa
(4)CH3COONH4
38.C11H20;86.8%
38.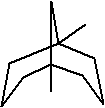 (2分)下面是某物质的键线式,其化学式为
,该物质中含碳的质量分数为
。
(2分)下面是某物质的键线式,其化学式为
,该物质中含碳的质量分数为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com