

2.③④①②
2.将足量BaCO3分别加入:① 30mL 水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L 氯化钡溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为: _____
1.白→淡黄→黄色 AgCl AgBr AgI的Ksp逐渐减小,白色AgCl沉淀转化成难溶的淡黄色的AgBr,然后淡黄色的AgBr再转变成更难溶的黄色AgI沉淀。
1.向AgNO3溶液依次加入氯化钠溶液、溴化钠溶液、碘化钾溶液,依次出现不同颜色的沉淀,沉淀的颜色变化是 _ ____ → _ _ ___ → ____ _。出现这种颜色变化的原因是:
_ _____ _
4、溶解度
不同的电解质在水中的溶解度差别很大,但难溶电解质与易溶电解质之间并无严格界限,习惯上将溶解度小于0.01g的电解质称为难溶电解质。
专题练习六:
3、沉淀的转化:加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子。使平衡向溶解的方向移动。
2.可逆过程 沉积和溶解速率相等 各离子浓度不变 改变温度、浓度等条件平衡移动
2、难溶电解质在水中的沉淀溶解平衡和化学平衡、电离平衡一样,合乎平衡的基本特征、满足平衡的变化基本规律,其基本特征为:(1)________ ____(2)__ ______ ____
(3)________ ____(4)________ ____
1、溶解平衡:
像AgCl这种难溶的物质,在水溶液中,在一定温度下,当沉淀溶解和生成的速率相等时,得到AgCl的饱和溶液,即建立下列动态平衡:
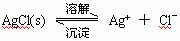
7、现有溶液中溶质的物质的量浓度均为0.01 mol·L-1 的四种溶液: ①盐酸;②硫酸;③醋酸;④ NaOH。
(1)它们的pH由小到大的顺序是②<①<③<④;
(2)它们溶液中水电离出的H+浓度由小到大的顺序是②<①=④<③;
(3)各取等体积的①、②、③溶液,分别跟颗粒大小相同的锌粒反应,开始时反应速率由小到大的顺序是③<①<②;
(4)取一定体积的④溶液,分别和①、②、③溶液完全中和,消耗①、②、③溶液的体积由小到大的顺序是__②<①=③__________________;
(5)取等体积的③、④溶液混合后,溶液中Na+、CH3COO-、H+、OH-离子的浓度由大到小的顺序是 c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(6)取a体积的①溶液和b体积的④溶液混合后,溶液的pH为3,则a:b=__11:9____。
考点六:沉淀-溶解平衡--难溶化合物的溶度积常数及其应用
[知识梳理]参见《3-2》P129解题方法技巧突破
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com