
3.单质的递变性规律:随原子序数的递增,单质的密度逐渐 ,单质熔沸点逐渐 。
2.位置:第 族。化合价只有 。
1.碱金属元素包含
3.氢氧化钠
⑴ 物理性质:俗名 、 、 。 色固体,极易潮解,有强烈的 性,能腐蚀磨口玻璃瓶,因此保存NaOH时 (能或不能)用玻璃塞。
⑵ 化学性质:具有 通性,例如可使指示剂变色、与酸性氧化物反应、与酸反应、与盐反应等。
重点掌握与酸性的气体的反应,写出下列反应方程式:
与适量CO2 ;
与过量CO2 ;
与适量H2S ;
与过量H2S ;
与适量SO2 ;
与过量SO2 。
[问题4]金属钠露置在空气中的变化过程:
银白色金属钠 表面变暗
表面变暗 出现白色固体
出现白色固体 表面变成溶液
表面变成溶液 白色块状物质
白色块状物质 白色粉末状物质
白色粉末状物质
反应过程:Na 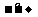
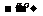
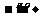

2.碳酸钠与碳酸氢钠
|
|
碳酸钠 |
碳酸氢钠 |
|
|
俗名 |
|
|
|
|
色态 |
|
|
|
|
溶解度 |
|
|
|
|
与酸反应 |
离子方程式 |
|
|
|
反应的快慢 |
|
|
|
|
现象 |
|
|
|
|
稳定性 |
|
|
|
|
用途 |
|
|
[问题3]它们的性质是(填写化学式):
①热稳定性: 加热容易分解;
②在水中溶解度(同温) 较大;
③碳酸钠从溶液中析出,通常带 个结晶水,而碳酸氢钠不带结晶水;
④饱和碳酸钠中通入足量CO2,出现 现象;
⑤相同浓度的碳酸钠与碳酸氢钠溶液的碱性 更强,相关反应为
;
⑥与酸反应放出CO2 较剧烈;
⑦同分子数的碳酸钠和碳酸氢钠与足量盐酸反应消耗盐酸多的是 ;
⑧等质量碳酸钠和碳酸氢钠与足量的盐酸反应时消耗盐酸多的 ;
⑨ (填“能”或“否”)利用Ba(OH)2溶液来鉴别碳酸钠与碳酸氢钠?写出两者与Ba(OH)2溶液反应的离子方程式: ;
(填“能”或“否”)利用BaCl2溶液来鉴别碳酸钠与碳酸氢钠?
⑩泡沫灭火器中加的是Al2(SO4)3溶液和 溶液,写出反应原理有关离子方程式 。
1.钠的氧化物和过氧化物
|
物质 |
氧化钠 |
过氧化钠 |
|
|
颜色、状态 |
|
|
|
|
电子式 |
|
|
|
|
氧的价态 |
|
|
|
|
生成条件 |
|
|
|
|
与水反应的化学方程式 |
|
|
|
|
与CO2反应的化学方程式 |
|
|
|
|
与酸反应 |
|
|
|
|
重要用途 |
-- |
|
|
|
互相联系 |
|
||
|
保存 |
|
|
|
[问题2]过氧化钠的强氧化性 (完成化学方程式)
(1)Na2O2投入FeCl2溶液中,可将Fe2+氧化Fe3+,同时生成Fe(OH)3沉淀(分为Na2O2适量和过量)
(2)Na2O2 投入品红溶液中,因其有氧化性,所以有 性,可使品红溶液 。
4.钠的冶炼:化学方程式;
3.主要化学性质:Na具有很强的 (氧化或还原)性, 主要体现为:
(1)与非金属单质反应
①与O2反应:常温下: ( 色固体)
加热或点燃: ( 色固体)
②与Cl2反应化学方程式为: ,
与S反应化学方程式为: (研磨易爆炸)
(2)与H2O反应:①现象:
②化学方程式: 离子方程式: 。
[问题1]将金属钠分别投入下列溶液中,各产生什么现象?写出有关的离子方程式。
(1)NH4Cl溶液 ; 。
(2)FeCl3溶液 ; 。
(3)NaHCO3溶液 ; 。
2.物理性质:金属钠质地 ,可以用 切割;它的密度比水 ;它的熔点比水的沸点 ;
金属钠通常保存在 里, (填“能”或“不能”)保存在CCl4里。
1.原子结构:钠核电荷数 ,核外 层电子,最外层电子数为 ,具有强 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com