

2.物理性质: 色晶体,易溶于水,
十二水合硫酸铝钾,俗称 ,化学式为
1.硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的化合物,它电离时能产生两种金属的阳离子,是一种复盐。
|
|
Mg(OH)2 |
Al(OH)3 |
|
物质类型 |
|
|
|
与酸反应 |
|
|
|
与强碱反应 |
-- |
|
|
受热分解 |
|
|
|
制法 |
|
|
注意: Al(OH)3的两性
[探索]有关Al(OH)3的图像问题
①.将NaOH溶液逐滴滴入到AlCl3溶液中,至过量。
现象: ;
反应方程式: 。

②.将AlCl3溶液逐滴滴入到NaOH溶液中,至过量。
现象: ;
反应方程式: 。

③.将氨水逐滴加入到AlCl3溶液中,至过量。
现象: ;
反应方程式: 。



④.将盐酸逐滴滴入到NaAlO2溶液中,至过量。
现象: ;
反应方程式: 。

⑤.将NaAlO2溶液逐滴滴入到盐酸中,至过量。
现象: ;
反应方程式: 。

⑥.将CO2通入NaAlO2溶液中,至过量。
现象: ;
反应方程式: 。

⑦.将AlCl3溶液逐滴滴入到NaAlO2溶液中,至过量。
现象: ;
 反应方程式: 。
反应方程式: 。
离子共存问题:Al3+与 因相互促进水解而不能大量共存;AlO2-与 等也不能大量共存。
氢氧化铝的制备
⑴用AlCl3选用的碱是 ,离子反应方程式是 ,
可否选作KOH 、NaOH,原因是 。
⑵用NaAlO2 选用的试剂是 ,离子方程式是 。
|
|
MgO |
Al2O3 |
|
|
重要物理性质 |
-- |
|
|
|
氧化物类型 |
|
|
|
|
主要化学性质 |
H2O |
|
|
|
H+ |
|
|
|
|
OH- |
-- |
|
|
|
重要用途 |
|
注意:Al2O3的两性
4.若产生相同物质的量的氢气,所需镁、铝的质量比是__ _。
3.若产生相同体积(同温同压)的氢气,所需镁、铝的物质的量之比是________ 。
2.相同物质的量的镁、铝分别与足量盐酸反应,在相同条件下产生氢气的体积比是_______。
|
|
Mg |
Al |
|
|
周期表中位置 |
|
|
|
|
与O2的反应 |
|
|
|
|
与其它非金属反应 |
|
|
|
|
与某些氧化物反应 |
Mg + CO2 -- |
Al + Fe2O3 -- |
|
|
与水的反应 |
|
-- |
|
|
与非氧化性酸反应 |
|
|
|
|
与氧化性酸反应 |
|
|
|
|
与强碱的反应 |
-- |
|
|
|
与某些盐溶液反应 |
|
|
|
|
工业制备 |
|
|
|
|
用途 |
制各种轻质合金 |
制合金、导线、铝箔、铝热剂 |
|
[思维启迪]
1.相同质量的镁、铝分别与足量盐酸反应,在相同条件下产生氢气的体积比是________。
专题十七 几种重要的金属--镁铝
[知识梳理]
1.铜的氧化物[CuO]
CuO+2HCl=CuCl2+H2O H2+CuO Cu+H2O C+2CuO
Cu+H2O C+2CuO 2Cu+CO2↑
2.铜的氢氧化物[Cu(OH)2]: 色 溶于水。
Cu(OH)2+2HCl=CuCl2+2H2O Cu(OH)2
2Cu+CO2↑
2.铜的氢氧化物[Cu(OH)2]: 色 溶于水。
Cu(OH)2+2HCl=CuCl2+2H2O Cu(OH)2 CuO+H2O
CH3CHO+2Cu(OH)2
CuO+H2O
CH3CHO+2Cu(OH)2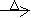 Cu2O↓+CH3COOH+2H2O
3.硫酸铜 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 CuSO4+Fe=Cu+FeSO4
CuSO4·5H2O
Cu2O↓+CH3COOH+2H2O
3.硫酸铜 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 CuSO4+Fe=Cu+FeSO4
CuSO4·5H2O CuSO4+5H2O ( 色粉末变为
色粉末);
CuSO4+5H2O ( 色粉末变为
色粉末);
CuSO4+5H2O =CuSO4·5H2O( 色粉末变成 色,常用来检验 的存在)
小结6:Fe、Cu 、Fe3+ 、Cu 2+ 、Fe之间的相互反应
方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com