
2、(2008·宿迁)下列离子能在pH=2的无色溶液中大量共存的是 ( )
A.SO42-、Fe3+、Na+、OH- B.K+、SO42-、Cu2+、NO3-
C.Cl-、K+、SO42-、Na+ D.Ca2+、Cl-、、Na+
1、(2008·太原)下列鉴别物质的方法中,切实可行的是 ( )
A.用酚酞溶液鉴别NaCl溶液和盐酸
B.用燃着的木条鉴别CO2和N2
C.用石蕊溶液鉴别稀盐酸和稀硫酸
D.用水鉴别NaOH和CaCO3固体
2、方法技巧
常见酸的性质:
|
酸 |
盐酸(HCl) |
硫酸(H2SO4) |
备注及用途 |
||
|
物理性质 |
无色液体,易挥发,有刺激性气味,在空气中形成白雾。(盐酸越浓越易挥发) |
无色液体,无挥发性,无气味 |
浓度越大,其密度就越大 |
||
|
化学性质 |
1、跟指示剂的反应 |
使紫色石蕊试液变红; 遇无色酚酞试液不变色。 |
利用这性质可以鉴别某物质是否是酸性 |
||
|
2、跟金属反应 |
2HCl+Zn=ZnCl2+H2↑ |
H2SO4+Zn=ZnSO4+H2↑ |
利用这性质可以制盐和氢气;可以判断金属的活泼性。 |
||
|
2HCl+Mg=MgCl2+H2↑ |
H2SO4+Mg=MgSO4+H2↑ |
||||
|
2HCl+Fe=FeCl2
+H2↑ |
H2SO4+Fe=FeSO4+H2↑ |
||||
|
3、跟金属氧化物的反应 |
Fe2O3 +6HCl
= 2FeCl3+ 3H2O |
Fe2O3+
3H2SO4= Fe2(SO4)3 + 3H2O |
可用于:制盐;金属表面除锈 |
||
|
2HCl + CuO =
CuCl 2+ H2O |
H2SO4
+ CuO =Cu SO4+ H2O |
||||
|
4、跟碱反应 |
HCl + NaOH = NaCl + H2O |
H2SO4+2NaOH=Na2SO4 + 2H2O |
利用这性质可以制盐;中和胃酸用---Al(OH)3;除去水垢中的Mg(OH)2 |
||
|
2HCl+Cu(OH)2=CuCl2 +2H2O |
H2SO4
+ Cu(OH)2= CuSO4+ 2H2O |
||||
|
5、跟某些盐的反应 |
2HCl+Na2CO3=2NaCl +H2O+CO2↑ |
H2SO4+Na2CO3=Na2SO4 +H2O+ CO2↑ |
利用这性质可以区别盐酸和硫酸----用BaCl2溶液 ;用盐酸制CO2气体;制盐;除去水垢中的CaCO3。 |
||
|
2HCl+CaCO3=CaCl2 + H2O+CO2↑ |
H2SO4
+CaCO3=Ca
SO4 +H2O+ CO2↑ |
||||
|
HCl + AgNO3 =
AgCl↓+ HNO3 |
H2SO4+
BaCl2=BaSO4↓+ 2HCl |
||||
 [例3](2008·烟台)炎炎夏日,喝上一杯汽水会给我们带来清爽凉快的感觉。右图是某种雪碧汽水标签中的部分内容,小明同学通过查阅资料得知:柠檬酸是一种无色晶体,能溶于水,属于有机酸,具有酸的通性。香料、苯甲酸钠、白砂糖等不显酸性。
[例3](2008·烟台)炎炎夏日,喝上一杯汽水会给我们带来清爽凉快的感觉。右图是某种雪碧汽水标签中的部分内容,小明同学通过查阅资料得知:柠檬酸是一种无色晶体,能溶于水,属于有机酸,具有酸的通性。香料、苯甲酸钠、白砂糖等不显酸性。
(1)以上信息中属于柠檬酸物理性质的是 。
(2)小明想利用此种雪碧汽水和同学们进一步验证柠檬酸的酸性:
①小明首先将适量的雪碧汽水倒入一洁净的试管中,然后滴加紫色石蕊试液,发现石蕊试液变红色。据此,小明断定柠檬酸确实具有酸性。他做出这种判断的依据是 。
②小红认为小明的实验结论不够严密,她的理由是 ;她建议在原来实验的基础上再进行一步操作,即把①中已经变红的混合液体加热,若看到 ,这样就能充分证明柠檬酸确实具有酸性了。
[答案](1)无色晶体,能溶于水 (2)①酸能使石蕊试液变红 ②汽水中的碳酸也能使石蕊试液变红 红色不褪去
[解析]因为酸可以使石蕊试液变红色,所以小明判断柠檬酸确实具有酸性;从雪碧汽水标签中,可以看此种汽水中含有碳酸水,即二氧化碳的水溶液,生成碳酸,碳酸也可以使石蕊试液变红色,故小明的推理不够严密;因为碳酸不稳定,加热会放出二氧化碳,若溶液仍为红色,就能充分证明柠檬酸确实具有酸性了。
[规律小结](1)物质不需要发生化学变化就表现出来的性质叫物理性质。 (2)物质在化学变化中表现出来的性质叫化学性质。(3)碳酸的性质:碳酸不稳定易分解而生成二氧化碳。
变式训练三
1、命题特点
此考点在往年中考中所占分值在3分到5分之间,难度系数在0.8左右,是中考常考知识点之一,这一部分的命题思路、内容主要有以下几点:
(1)以考查酸的物理性质、化学性质为内容的选择题、填空题,以及结合实际进行探究的实验探究题;
(2)联系实际以考查酸的通性为内容的选择题、填空题、实验探究题。
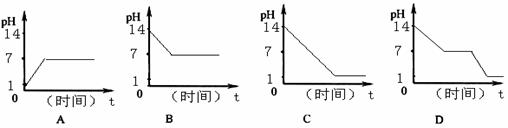
1、(2009·恩施自治州)下图可表示将pH=1的盐酸加入到pH=14的氢氧化钠溶液中恰好完全反应的是( )
 2、(2009·佛山)在氢氧化钠溶液中加入盐酸,至恰好完全反应,反应的微观示意图见右下图。下列有关认识错误的是( )
2、(2009·佛山)在氢氧化钠溶液中加入盐酸,至恰好完全反应,反应的微观示意图见右下图。下列有关认识错误的是( )
A.反应结束时溶液的pH=7
B.反应前后元素的种类没有变化
C.酸与碱的反应属于复分解反应
D.该微观图还可说明所有物质都是由分子构成的
2、方法技巧
酸和碱互相交换成分,生成盐和水的反应叫中和反应(中和反应属于复分解反应)中和反应的实质是:H+和OH--结合生成水(H2O)。
注意:有盐和水生成的反应,不一定是中和反应
如:2NaOH+CO2 = Na2CO3+H2O
所以只要酸碱发生了反应就叫中和,不管进行到何种程度。 判断是否完全中和是以酸碱是否恰好完全反应作为标准的。
[例2](2008·常州)下列反应中属于中和反应的是 ( )
A、Na2CO3+2HCl== 2NaCl+H2O+CO2↑
B、2NaOH+H2SO4== Na2SO4+2H2O
C、SO2+2NaOH== Na2SO3+H2O
D、Zn+CuSO4===ZnSO4+Cu
[答案]B
[解析]本题主要考查中和反应,中和反应是指酸和碱作用生成盐和水的反应。A是盐和酸的反应,C是氧化物和碱的反应,D是单质和化合物(盐)的反应,所以它们都不是中和反应。
[规律小结]中和反应是指酸和碱作用生成盐和水的反应,但并不是所有生成水的反应都是中和反应。
变式训练二
1、命题特点
此考点在往年中考中所占分值在3分到4分之间,难度系数在0.9左右, 对中和反应的考查主要体现在联系日常生活,用中和反应的知识解决生产、生活中的实际问题为背景的选择题、填空题、在计算题中也有涉及。
3、(2008·南京)南南同学跟妈妈学烧紫甘蓝(紫卷心菜),用油炒后加入食醋,发现紫色的叶片立即变红,激发了他的探究欲望。
[提出问题]紫甘蓝的汁液能作酸碱指示剂吗?
[进行实验]取紫甘蓝叶片少许在研钵中捣烂,用少量水浸泡,滤出蓝紫色的汁液。将汁液分别滴人下列液体中,观察其显示的颜色并记录。
|
液体名称 |
白醋 |
蒸馏水 |
食盐溶液 |
肥皂水 |
纯碱溶液 |
|
紫甘蓝汁液显示的颜色 |
红色 |
蓝紫色 |
蓝紫色 |
蓝色 |
绿色 |
[得出结论1]紫甘蓝的汁液 (选填“能”或“不能”)作酸碱指示剂。
[质疑并求证]紫甘蓝的汁液在均为碱性的肥皂水和纯碱溶液中,为何显示不同颜色?
用pH试纸测得上述肥皂水和纯碱溶液的PH分别为9和11,则肥皂水的碱性比纯碱溶液的碱性(选填“强”或“弱”) 。
|
PH |
7-9 |
10-11 |
12-14 |
|
紫甘蓝汁液显示的颜色 |
蓝色 |
绿色 |
黄色 |
查阅资料:
[得出结论2]紫甘蓝的汁液在不同pH范围内显示的颜色不同,利用紫甘蓝的汁液还可以区分液体碱性的 。
[拓展应用]柠檬酸是制汽水的原料之一,为探究其固体是否显酸性,南南同学联想到教材上二氧化碳相关实验的设计,准备了三朵用紫甘蓝的汁液染成蓝紫色的干燥小花。
取干燥的花①和喷上水的花②,分别放人盛满二氧化碳的两个集气瓶中,发现花①不变色,花②变成了 色。在干燥的花③上直接撤少量柠檬酸固体,花不变色,说明了 ;再向该花喷水,蓝紫色的花上出现了红色。
[反思]上述花的变色均与水有关,水的作用分别是:
花②中 ;
花③中 。
2、(2009·海南)紫甘蓝汁液在不同酸碱度下的颜色变化如下
|
pH |
1 |
2-3 |
4-6 |
7-9 |
10 |
11 |
12-14 |
|
颜色 |
深红 |
紫红 |
浅紫 |
蓝 |
绿 |
黄绿 |
黄 |
下列物质能使紫甘蓝汁液变黄的是( )
A.盐酸 B.水 C.氢氧化钠溶液 D.酒精
1、(2009·肇庆)用pH试纸测定溶液pH的正确操作是( )
A.pH试纸直接浸入待测液
B.pH试纸先用水润湿再浸入待测液
C.pH试纸浸液后过一会儿观察
D.用玻棒蘸取待测液涂于pH试纸上,马上观察
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com