
1. 红珊瑚栖息于200-2000米的海域,产于台湾海峡、南中国海,它与琥珀、珍珠被统称为有机宝石。在中国,珊瑚是吉祥富有的象征,一直用来制做珍贵的工艺品。红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,其红色是因为在海底长期积淀某种元素,该元素是:
A..Na B. Fe C. Si D. Cu
31.
 烟气中
烟气中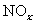 是NO和
是NO和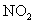 的混合物(不含
的混合物(不含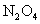 )。
)。
 (1)根据废气排放标准,
(1)根据废气排放标准,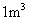 烟气最高允许含400mg
烟气最高允许含400mg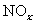 。若
。若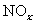 中NO质量分数为0.85,则
中NO质量分数为0.85,则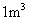 烟气中最高允许含NO__________L(标准状况,保留2位小数)。
烟气中最高允许含NO__________L(标准状况,保留2位小数)。
 (2)工业上通常用溶质质量分数为0.150的
(2)工业上通常用溶质质量分数为0.150的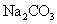 水溶液(密度1.16g/mL)作为
水溶液(密度1.16g/mL)作为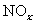 吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
 (3)已知:
(3)已知: 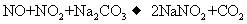 ①
①

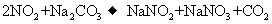 ②
②

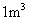 含2000 mg
含2000 mg 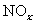 的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气___________排放标准(填“符合”或“不符合”),理由:____________________。
的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气___________排放标准(填“符合”或“不符合”),理由:____________________。
 (4)加入硝酸可改变烟气中NO和NO2的比,反应为:
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:
 NO+2HNO3→3NO2+H2O
NO+2HNO3→3NO2+H2O
 当烟气中
当烟气中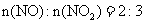 时,吸收率最高。
时,吸收率最高。

 烟气含2000mg
烟气含2000mg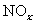 ,其中
,其中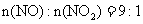 。
。
 计算:(i)为了达到最高吸收率,
计算:(i)为了达到最高吸收率,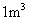 烟气需用硝酸的物质的量(保留3位小数)。
烟气需用硝酸的物质的量(保留3位小数)。
 (ii)
(ii)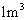 烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。

|
题 号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
|
答 案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|



30. 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧: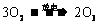
 (1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______________g/mol
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______________g/mol (保留一位小数)。
(保留一位小数)。
 (2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________L。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________L。
 (3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为__________________。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为__________________。
29. 尼龙-66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出两条合成路线)。
尼龙-66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出两条合成路线)。

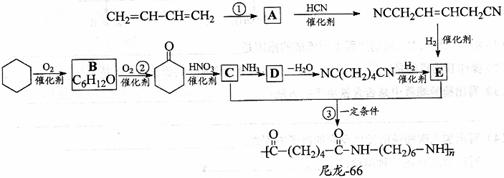
 完成下列填空:
完成下列填空:
 (1)写出反应类型:反应②__________________
(1)写出反应类型:反应②__________________
反应③___________________________
 (2)写出化合物D的结构简式:_______________________________________________
(2)写出化合物D的结构简式:_______________________________________________
 (3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:
___________________________________________________________________________ (4)写出反应①的化学方程式:
(4)写出反应①的化学方程式:

___________________________________________________________________________
 (5)下列化合物中能与E发生化学反应的是_________。
(5)下列化合物中能与E发生化学反应的是_________。
 a.
a.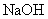 b.
b.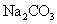 c.
c.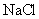 d.
d.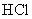
 (6)用化学方程式表示化合物B的另一种制备方法(原料任选):
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):
 ___________________________________________________________________________
___________________________________________________________________________
28. 环氧氯丙烷是制备树脂的主要原料,工业上有不同的合成路线,以下是其中的两条(有些反应未注明条件)。
环氧氯丙烷是制备树脂的主要原料,工业上有不同的合成路线,以下是其中的两条(有些反应未注明条件)。

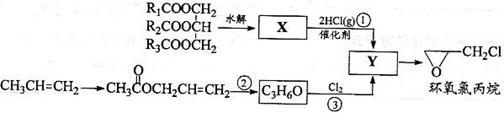
 完成下列填空:
完成下列填空:
 (1)写出反应类型:反应①_________________ 反应③___________________
(1)写出反应类型:反应①_________________ 反应③___________________
 (2)写出结构简式:X_____________________
Y________________________
(2)写出结构简式:X_____________________
Y________________________
 (3)写出反应②的化学方程式:______________________________________________
(3)写出反应②的化学方程式:______________________________________________
 (4)与环氧氯丙烷互为同分异构体,且属于醇类的物质(不含
(4)与环氧氯丙烷互为同分异构体,且属于醇类的物质(不含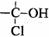 及
及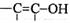 结构)
结构) 有__________种。
有__________种。
27. 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

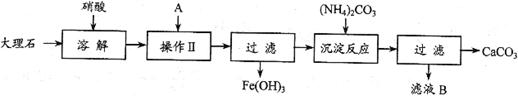
 (1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
(1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
 (2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
(2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
 (3)写出检验滤液中是否含铁离子方程式:_____________________________________
(3)写出检验滤液中是否含铁离子方程式:_____________________________________
 ______________________________________________________________________。
______________________________________________________________________。
 (4)写出加入碳酸铵所发生反应的离子方程式:________________________________
(4)写出加入碳酸铵所发生反应的离子方程式:________________________________
 写出滤液B的一种用途:_________________________
写出滤液B的一种用途:_________________________
 (5)
(5)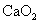 中一般含
中一般含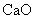 。试按下列提示完成
。试按下列提示完成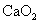 含量分析的实验设计。
含量分析的实验设计。
 试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞
仪器:电子天平、锥形瓶、滴定管
 实验步骤:
实验步骤:
 ①____________;②加入_________________;③加入酚酞,用氢氧化钠标准溶液滴定。
①____________;②加入_________________;③加入酚酞,用氢氧化钠标准溶液滴定。
 (6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应,实际操作中过量半滴(1 mL溶液为25滴),则相对误差为______________
(6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应,实际操作中过量半滴(1 mL溶液为25滴),则相对误差为______________
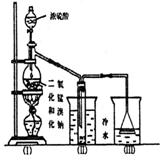
26. 根据图实验,填空和回答同题:
根据图实验,填空和回答同题:
(1)烧瓶中所发生的主要反应的化学方程式是 ,装置(Ⅱ)的烧杯中冷水所起的作用是 ,装置(Ⅲ)的烧杯中液体的作用是 。
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,
用橡皮管连接的两玻璃管口要相互紧靠,这是因
为 。
(3)装置(Ⅲ)烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因。
24. 某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
⑴请将Au2O3之外的反应物与生成物分别填如以下空格内。
⑵反应中,被还原的元素是___________,还原剂是____________。
⑶将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。

⑷纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
 25.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
25.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
 (1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:


 ①该反应的平衡常数表达式为:K=
①该反应的平衡常数表达式为:K=
 ②该温度下,在2 L盛有
②该温度下,在2 L盛有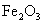 粉末的密闭容器中通入CO气体,10 min后,生成了单
粉末的密闭容器中通入CO气体,10 min后,生成了单 质铁11.2 g。则10 min内CO的平均反应速率为
质铁11.2 g。则10 min内CO的平均反应速率为
 (2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
 ①
②
①
②
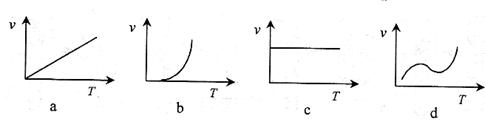
 (3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v) 和温度(T)的关系示意图中与铝热反应最接近的是
。
和温度(T)的关系示意图中与铝热反应最接近的是
。

 (4)写出氢氧化铝在水中发生酸式电离的电离方程式:_________________________________
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:_________________________________
 欲使上述体系中
欲使上述体系中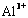 浓度增加,可加入的物质是___________________。
浓度增加,可加入的物质是___________________。
23. 海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
 (1)在光照条件下,氯气和氢气反应过程如下:
(1)在光照条件下,氯气和氢气反应过程如下:
 ①
① ②
②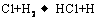 ③
③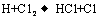 ……
……
 反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属 于 键(填“极性”或“非极性”)。
于 键(填“极性”或“非极性”)。
 (2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
 (用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
 (3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
 a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
 b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小
b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小
 c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
 d.卤素单质与氢气化合按
d.卤素单质与氢气化合按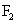 、
、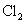 、
、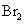 、
、 的顺序由难变易
的顺序由难变易
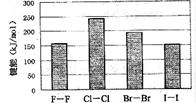
 (4)卤素单质的键能大小如右图。由图推断:
(4)卤素单质的键能大小如右图。由图推断:
 ①非金属性强的卤素,其单质分子的化学键
①非金属性强的卤素,其单质分子的化学键  断裂(填“容易”或“不容易”或“不一定容易”)。
断裂(填“容易”或“不容易”或“不一定容易”)。
 ②卤素单质键能大小与键长的关系为:
②卤素单质键能大小与键长的关系为:

22. 实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所
实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所 得固体中含金属单质为18 g,则该氧化物粉末可能是
得固体中含金属单质为18 g,则该氧化物粉末可能是
 A.
A. B.
B.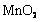 和
和 C.
C.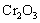 和
和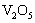 D
D 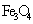 和FeO
和FeO

 第II卷 (共84分)
第II卷 (共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com