
11.高铁电池的总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是

A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
B.充电时阴极反应为:Fe(OH)3-3e-+5 OH-==FeO42-+4H2O
C.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
D.充电时阳极附近溶液的碱性增强
10.设NA表示阿伏加德罗常数的数值,下列说法中不正确的是
A.一定量的Fe与1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.160 g CuO 加热到1273K时完全分解,若转移2NA个电子,则反应方程式为:
 2CuO 2Cu+O2↑
2CuO 2Cu+O2↑
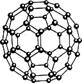
C.N60结构如右图,28 g N60单质中含有的N-N键个数为NA
D.0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3NA
9. 某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论是
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论是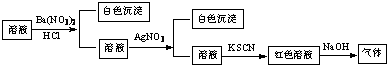

A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
8. 常温下,有甲、乙两份体积均为l L,浓度均为0.1mol/L的氨水,其pH为11。①甲
用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol/L的盐酸
混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=bmol。则a、b正确的答案组合是
A.9-11之间; 0.1 B.9-11之间; 0.2
C.12-13之间; 0.2 D.13; 0.1
7. 不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
|
序号 |
甲 |
乙 |
丙 |
|
① |
CO2 |
SO2 |
石灰水 |
|
② |
HCl |
CO2 |
石灰水 |
|
③ |
CO2 |
SO2 |
Ba(NO3)2 |
|
④ |
NO2 |
SO2 |
BaCl2 |
|
⑤ |
CO2 |
NH3 |
CaCl2 |
A.②③④ B.②③④⑤ C.①③④ D.①②③④
6.在c(H+)∶c(OH-)=1∶2的水溶液中能大量共存的离子组是
A.K+、Al3+、H2PO4-、SO42- B.Ca2+、NH4+、CO32-、Cl-
C.Na+、K+、NO3-、ClO- D.Na+、Ba2+、I-、SO32-
5. 下列文字表述与反应方程式对应且正确的是
A.用石墨作两电极电解MgCl2溶液:2C1-+2H2O  C12↑+2OH-+H2↑
C12↑+2OH-+H2↑
B.硫氢化钠的水解:HS-+H2O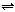 H3O++S2-
H3O++S2-
C.用氢氧化钡溶液中和硫酸氢铵溶液:H++SO42-+Ba2++OH-=H2O+BaSO4↓
D.用饱和纯碱溶液溶解苯酚:CO32-+C6H5OH→HCO3-+C6H5
4.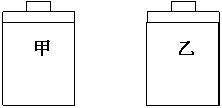 常温常压下,在带有相同质量活塞的容积相等的
常温常压下,在带有相同质量活塞的容积相等的
甲、乙两容器里,分别充有二氧化氮和空气,现
分别进行下列两实验:(N2O4 2NO2 △H >0)
2NO2 △H >0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,
正确的是
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
3.下列叙述中,错误的是
A.虽然固体氯化钠不能导电,但氯化钠是电解质
B.纯水的pH随温度的升高而减小
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大
D.在纯水中加入少量硫酸铵,可抑制水的电离
2. 某炼金厂的废水因暴雨溢出,导致河水严重污染。废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是
A.CN-可以和稀硫酸反应生成HCN B.CN-可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被F-还原 D.HCN的电子式为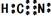
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com