
20. (10分)用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液500mL,每次实验均充分反应。实验记录如下:
|
实验次数 |
样品质量/g |
沉淀质量/g |
|
1 |
1.716 |
2.758 |
|
2 |
2.574 |
|
|
3 |
3.432 |
5.516 |
|
4 |
4.290 |
5.516 |
回答下列问题:
(1)第2次实验中产生沉淀质量是多少,将结果填入表格空白处。
(2)Ba(OH)2溶液中溶质的物质的量浓度是 。
(3)第2次实验样品中NaHCO3的物质的量是 。
(4)室温下取第2组实验所得溶液体积的1/10,加水配成500mL溶液,求稀释以后溶液的pH?(要求书写计算过程)
4、温度变化也可能使化学平衡向左移动,抑制配合物的形成。
[实验准备]
(1)CuSO4溶液的准备:分别取3份8g无水CuSO4固体,各加入水稀释到100ml、50 ml、25 ml(第三种溶液已饱和);
(2)NaBr溶液的准备:分别取2.06g、4.12g、4.12gNaBr晶体,各加入水稀释到50 ml、50 ml、25 ml。
问题1:粗略配制上述溶液需要用到的仪器有: ;
[实验现象]
表1、不同浓度的Br-溶液与某一浓度的Cu2+溶液反应
|
编号 |
5 mlCu2+溶液(mol·L-1) |
10 ml Br-溶液(mol·L-1) |
现象 |
|
① |
第一份CuSO4溶液 |
a |
溶液由蓝色变为蓝绿色 |
|
② |
第一份CuSO4溶液 |
b |
溶液由蓝色变为草绿色 |
|
③ |
第一份CuSO4溶液 |
c |
溶液由蓝色变为亮绿色 |
表2、不同浓度的Cu2+溶液与某一浓度的Br-溶液反应
|
编号 |
5 mlCu2+溶液(mol·L-1) |
10 ml Br-溶液(mol·L-1) |
现象 |
|
① |
d |
第一份NaBr溶液 |
溶液由蓝色变为蓝绿色 |
|
② |
e |
第一份NaBr溶液 |
溶液由蓝色变为草绿色 |
|
③ |
f |
第一份NaBr溶液 |
溶液由蓝色变为亮绿色 |
表3、不同温度对配合物形成的影响
|
编号 |
5 mlCu2+溶液(mol·L-1) |
10 ml Br-溶液(mol·L-1) |
温度 |
现象 |
|
① |
第一份CuSO4溶液 |
第一份NaBr溶液 |
25℃ |
溶液由蓝色变为蓝绿色 |
|
② |
第一份CuSO4溶液 |
第一份NaBr溶液 |
60℃ |
溶液由蓝色变为草绿色 |
|
③ |
第一份CuSO4溶液 |
第一份NaBr溶液 |
75℃ |
溶液由蓝色变为亮绿色 |
问题2:上表中b= mol/L e= mol/L;
问题3:通过表3得出的结论是 ;
问题4:上述反应根据的原理是 。
3、温度变化可能影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动。
2、
1、增大配位离子(Br-)的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;
19. (12分)配位平衡也是一种相对平衡状态,存在着平衡移动,它同溶液的pH值、沉淀的反应、氧化还原反应等有密切关系,也就是说,在溶液中形成配位物时,常常出现颜色的变化、溶解度的变化、PH值的改变等现象。Br-与Cu2+反应生成配位化合物,就存在配位平衡。
Cu2++ 2Br-  Cu Br2
Cu2++
4Br-
Cu Br2
Cu2++
4Br-  [Cu Br4]
2-
[Cu Br4]
2-
已知:Cu2+在水溶液中显蓝色,[Cu Br4] 2-在水溶液中显黄色,蓝色与黄色并存时显绿色,[Cu Br4] 2-浓度越大,颜色越深。同时,温度可能对[Cu Br4] 2-的稳定性有影响。
某化学探究小组的同学为了探究温度、浓度对Br-与Cu2+的配位平衡的影响,于是做了下列的假设与猜想(填写空缺的假设):
[假设与猜想]
18.(10分)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。
(1)pH=3时溶液中铜元素的主要存在形式是:
(写化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶
液的pH为 (填字母)
A、<1 B、4左右 C、>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,
(能、不能)通过调节溶液pH的方法来除去,理由
是
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。
(5)已知一些难溶物的溶度积常数如下表。
|
物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
|
Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-53 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 除去它们。
A、NaOH B、FeS C、Na2S (选填序号)
17.(10分)利用天然气合成氨的工艺流程示意如下:
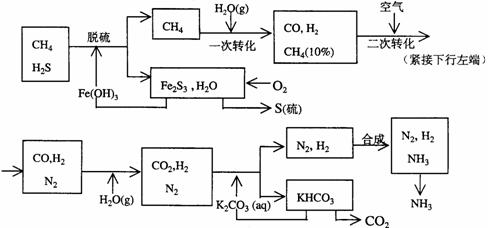
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于
(写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)
16.(8分)下图所示各物质是由1-20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
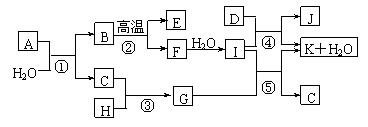
请回答下列问题:
⑴物质E的电子式是____________。
⑵反应⑤的化学方程式为___________________________________________。
⑶反应③的现象为_________________________________________________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为______________________。
21.(12分)
⑴_______ _______ __________ ⑵________ __________________________________
⑶_________ ⑷______ ⑸_________ __________ ⑹___________ ______________
称)。两个滴定中,终点时溶液颜色为________色,且30 秒内不变色。
⑷该化合物KxFe(C2O4)y·3H2O中,x=_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com