

19.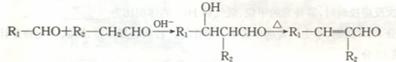 (12分)已知:
(12分)已知:
呋喃丙胺是一种临床上广泛使用的高效麻醉剂,也可用于治疗心律失常。由常见化工原料
呋喃甲醛合成呋喃丙胺的流程如下:
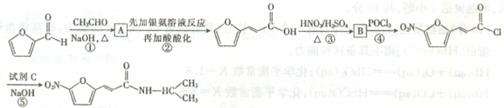 试回答下列问题:
试回答下列问题:
(1) 物质A的结构简式为 ,反应①-⑤中属于取代反应的有 (填序号)。
(2) 呋喃甲醛中分子的核磁共振氢谱图上共有 个吸收峰,各吸收峰的面积比为 。
(3) 呋喃丙烯酸具有多种同分异构体,其中属于醛类且含有酚羟基的同分异构体共有 种。
(4) 反应③的化学方程式为 .
(5) 反应⑤在生成呋喃丙胺的同时,还有HCl生成,则试剂c的分子式为_______________。
(6) 有同学建议,为降低生产成本,反应②改用酸性高锰酸钾溶液作氧化剂。简要评价此建议是否合理: .
七,本题包括1小题,共8分.
18.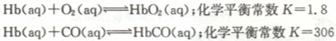 (10分)血红蛋白(Hb)分子中存在一个Fe2+核心,具有携带Q或CO的能力,而高铁血红蛋白
(10分)血红蛋白(Hb)分子中存在一个Fe2+核心,具有携带Q或CO的能力,而高铁血红蛋白
则不具备这种能力。
(1) 高压氧舱可用于煤气中毒急救,当患者血液内c(Hb02)≈c(HbCO)时O2(aq)与CO(aq)的物质的量浓度之比应该大于 才有可能使患者逐渐“置换”出体内血液中的CO。
(2) NaNO2的外观与NaCl极为相似,易被当做食盐误食导致人体严重缺氧、危及生命,其化学反应原理如下。试完成下列离子方程式的配平:

(3) 维生素C可以用做NaNO2。中毒患者的急救,其主要化学原理可表达如下,试完成相关
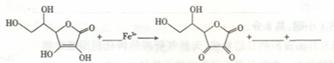 反应的离子方程式并配平:
反应的离子方程式并配平:
(4) 城市大气中的CO和NO主要来源于汽车尾气,而影响汽车尾 气中CO、NO含量的主要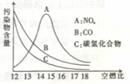 因素为空气与燃料蒸气的体积比(简称空燃比)以及发动机的点火方式等。
因素为空气与燃料蒸气的体积比(简称空燃比)以及发动机的点火方式等。
当空燃比偏低时,汽车尾气中的 含量明显升高,这是因为 ;
当空燃比偏高时,汽车尾气中的 含量明显升高,这是因为 ;
当空燃比过高时,汽车尾气中的 含量反而下降,而尾气酸度有所升高,则导致尾气酸度升高的化学方程式为 (不必配平)。
六,本题包括1小题,共12分。
17.(8分)如图为一些常见无机物之间的转化关系,其中:常温下E是一
种无色无味的气体。;F是一种淡黄色粉末,G是一种无色无味的气体。
请回答下列问题:
 (1) F的电子式为
;在反应②中,每生成2.24 L(标
(1) F的电子式为
;在反应②中,每生成2.24 L(标
准状况下)气体G,反应转移电子 NA(NA一代表阿伏加德罗常数的数值)。
(2) 若A、C、D中均含有氯元素,反应产物中C与D的物质的量之比为5:1,B的焰色反应呈黄色,
则反应①的离子方程式为 。
(3) 若C、D均为气体,且都能使澄清石灰水变浑浊,B、C、D、E中含有同种元素,则A与B分别为 、 。(写名称)
(4) 若A与B均为固体化合物,C是常见的一种中性干燥剂,且1.7 g D在铂作催化剂的条件下与O2完全反应生成气态产物时放出热量22.67 kJ,则该反应的热化学方程式为 .
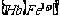 五,本题包括1小题,共10分。
五,本题包括1小题,共10分。
16. (10分)铜是人类最早使用的金属之一,铜的矿物主要有辉铜矿(Cu2S)、黄铜矿(CuFeS2)、赤铜矿(Cu20)等。铜及其化合物一般都有颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H20呈蓝色等。已知:①CuO经高温灼烧生成Cu20;②Cu2O属于碱性氧化物;③Cu2O+2H+====Cu+Cu2++H2O。
(10分)铜是人类最早使用的金属之一,铜的矿物主要有辉铜矿(Cu2S)、黄铜矿(CuFeS2)、赤铜矿(Cu20)等。铜及其化合物一般都有颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H20呈蓝色等。已知:①CuO经高温灼烧生成Cu20;②Cu2O属于碱性氧化物;③Cu2O+2H+====Cu+Cu2++H2O。
 (1) 工业冶炼铜的主要原料是黄铜矿,其生产过程开始的两步是:
(1) 工业冶炼铜的主要原料是黄铜矿,其生产过程开始的两步是:
 ①富集:将矿物进行浮选;
①富集:将矿物进行浮选;

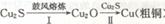 ②焙烧:把得到的精矿用空气进行焙烧,将其中的铁元素转变为硫化亚铁、铜元素转变为硫化亚铜,试写出焙烧反应的化学方程式并配平:
。
②焙烧:把得到的精矿用空气进行焙烧,将其中的铁元素转变为硫化亚铁、铜元素转变为硫化亚铜,试写出焙烧反应的化学方程式并配平:
。
 (2)其后续生产过程如下:,当用于步骤ICu2S的量是用于
(2)其后续生产过程如下:,当用于步骤ICu2S的量是用于
 步骤Ⅱ的
倍时,恰好能使Cu2S全部转化为铜。
步骤Ⅱ的
倍时,恰好能使Cu2S全部转化为铜。
(3) 将经高温灼烧后的CuO样品投入足量的热的稀硝酸溶液中,下列有关说法中正确的是
A.如果溶液呈蓝色,说明样品没有分解
B.如果溶液变为蓝色、同时有紫红色固体出现,说明样品全部生成了Cu2O
C.溶液中最终不可能有紫红色固体出现
D.这种实验的结果无法说明CuO分解的程度
E.如果溶液中出现蓝色,最终没有紫红色固体出现,说明CuO完全分解了
(4) 黄铜矿冶炼铜产生的炉渣中含有Fe2O3、FeO、SiO2、A12O3等物质。选用提供的试剂,设计一个实验,以验证炉渣中含有FeO,应选择的试剂为 ______________。
A稀盐酸 B.稀硫酸 C KSCN溶液 D KMnO4溶液 E.NaOH溶液
证明炉渣中含有FeO的实验现象为
。
15.(12分)紫菜与海带类似,是一种富含生物碘的海洋植物。商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取。

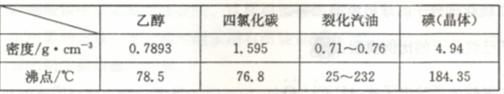




 (1) 实验室中焙烧紫菜用到的仪器有 (填写相应的字母)。
(1) 实验室中焙烧紫菜用到的仪器有 (填写相应的字母)。
 A烧杯 B表面皿 C蒸发皿 D坩埚 E.试管 F.酒精灯 G.三脚架 H.泥三角
A烧杯 B表面皿 C蒸发皿 D坩埚 E.试管 F.酒精灯 G.三脚架 H.泥三角
 (2) 将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,其目的是
。
(2) 将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,其目的是
。
 (3) (填一种基本操作的名称),弃去残渣,将所得的产物转入
(填一种玻璃仪器的名称)中,加入少量的
(填本题表格中一种最佳化学试剂的名称),
(3) (填一种基本操作的名称),弃去残渣,将所得的产物转入
(填一种玻璃仪器的名称)中,加入少量的
(填本题表格中一种最佳化学试剂的名称), 振荡、静置,首先将
分离出来。不使用另外两种试剂的主要原因分别是:
振荡、静置,首先将
分离出来。不使用另外两种试剂的主要原因分别是:
 ① ;
① ;
 ②
②
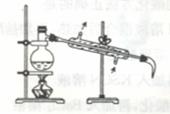
 (4) 将下列装置图中缺少的必要仪器补画出来以最终获得固态的单质碘(不考虑碘的进一步提纯):
(4) 将下列装置图中缺少的必要仪器补画出来以最终获得固态的单质碘(不考虑碘的进一步提纯):






 四,本题包括2小题,共18分。
四,本题包括2小题,共18分。
14.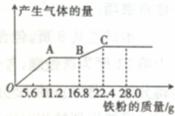
 将某稀硫酸和稀硝酸的混合溶液200 mL。平均分成两等份。向其中一份中逐渐加人铜粉,最多能溶解19.2 g;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸均只被还原为NO气体)。下列分析或结果不正确的是
将某稀硫酸和稀硝酸的混合溶液200 mL。平均分成两等份。向其中一份中逐渐加人铜粉,最多能溶解19.2 g;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸均只被还原为NO气体)。下列分析或结果不正确的是
 A.第二份溶液中最终的溶质为FeSO4
A.第二份溶液中最终的溶质为FeSO4
 B.OA段产生的气体是NO,AB段的反应为 Fe+2Fe3+===3Fe2+,BC
B.OA段产生的气体是NO,AB段的反应为 Fe+2Fe3+===3Fe2+,BC
段产生的气体是H2
 C.原混合酸中NO3-的物质的量共为0.2 mol
C.原混合酸中NO3-的物质的量共为0.2 mol
 D.原混合酸中H2SO4的物质的量浓度为5 moI·L-1
D.原混合酸中H2SO4的物质的量浓度为5 moI·L-1
11.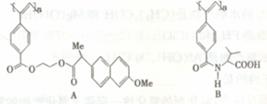
 导电聚合物的合成使高分子材料进入“合成金属”和塑料电子学时代,以下是我国化学家近年来合成的一些导电聚合物衍生物分子(Me指甲基):
导电聚合物的合成使高分子材料进入“合成金属”和塑料电子学时代,以下是我国化学家近年来合成的一些导电聚合物衍生物分子(Me指甲基):





 下列关于上述高分子的说法中正确的是
下列关于上述高分子的说法中正确的是
 A. A和B的单体都是二烯烃的衍生物 B. A和B均能在一定条件下水解形成相同的高分子化合物
A. A和B的单体都是二烯烃的衍生物 B. A和B均能在一定条件下水解形成相同的高分子化合物
 C .B水解所得的小分子是一种
C .B水解所得的小分子是一种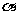 一氨基酸 D. A和B各1mol与热碱液反应,均最多消耗2molNaOH
一氨基酸 D. A和B各1mol与热碱液反应,均最多消耗2molNaOH
 12.常温下将NaOH溶液与CH3COOH稀溶液混合,不可能出现的结果是
12.常温下将NaOH溶液与CH3COOH稀溶液混合,不可能出现的结果是
 A.pH=7且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
B.pH<7且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
A.pH=7且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
B.pH<7且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
C.pH>7且c(Na+)+c(H+)=c(CH3COO-)+c(OH-) D.pH>7且c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.pH>7且c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
 13.某兴趣小组为探究外界条件对可逆反应 的影响,在恒温条
13.某兴趣小组为探究外界条件对可逆反应 的影响,在恒温条
 件下往一个容积为10 L的密闭容器中充入1
mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
件下往一个容积为10 L的密闭容器中充入1
mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。




 针对上述系列试验,下列结论中正确的是
针对上述系列试验,下列结论中正确的是
 A.Ⅰ中
A.Ⅰ中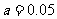 B.对应的操作方法可以是压缩反应容器的体积
B.对应的操作方法可以是压缩反应容器的体积
 C.实验Ⅳ结果的产生可能是因为采用了补充生成物D的方法
C.实验Ⅳ结果的产生可能是因为采用了补充生成物D的方法
 D.将Ⅲ与I比较,可以判断出正反应一定是放热反应
D.将Ⅲ与I比较,可以判断出正反应一定是放热反应
10. 下列离子方程式书写正确的是
下列离子方程式书写正确的是
 A.向氯化铝溶液中加入过量氨水:A13++4NH3·H2O=====A102-+4NH4++2H2O
A.向氯化铝溶液中加入过量氨水:A13++4NH3·H2O=====A102-+4NH4++2H2O
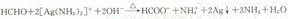
 B.甲醛与足量银氨溶液共热:
B.甲醛与足量银氨溶液共热:
 C.用石墨电极电解硝酸银溶液:
C.用石墨电极电解硝酸银溶液:
2Ag++2H20=====2Ag+O2↑十+4H+
 D.向碳酸氢钙溶液中滴加过量的烧碱溶液:Ca2++2HCO3-+2OH-=====CaC03↓+2H20十CO32-
D.向碳酸氢钙溶液中滴加过量的烧碱溶液:Ca2++2HCO3-+2OH-=====CaC03↓+2H20十CO32-
1.下列有关化学用语表达正确的是
A.二硫化碳分子的球棍模型: B.环己烷分子的比例模型:
B.环己烷分子的比例模型:
C.次氯酸分子的电子式: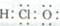 D.淀粉的实验式:CH2O
D.淀粉的实验式:CH2O
 2.设NA为阿伏加德罗常数的数值,下列有关说法中正确的是
2.设NA为阿伏加德罗常数的数值,下列有关说法中正确的是
 A.3 mol铁与足量的水蒸气充分反应,转移8NA个电子
A.3 mol铁与足量的水蒸气充分反应,转移8NA个电子
 B.足量的铜与含2 mol H2SO4的浓硫酸充分反应,可生成NA个SO2分子
B.足量的铜与含2 mol H2SO4的浓硫酸充分反应,可生成NA个SO2分子
 C.200mL 5mol·L-1Na2CO3晚溶液中,含NA个CO32-
C.200mL 5mol·L-1Na2CO3晚溶液中,含NA个CO32-
 D.78 g过氧化钠晶体中含有2NA个阴离子
D.78 g过氧化钠晶体中含有2NA个阴离子
 3.下列溶液中,各组离子一定能够大量共存的是
3.下列溶液中,各组离子一定能够大量共存的是
 A.无色溶液中:K+、H+、SO32-、MnO4-
B.
A.无色溶液中:K+、H+、SO32-、MnO4-
B.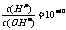 的溶液中:K’、Na+、CO32-、AIO2-
的溶液中:K’、Na+、CO32-、AIO2-
 C.能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-
D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-
C.能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-
D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-
 4.化学实验中有时需要将某些溶液或试剂进行酸化,下列酸化方法正确的是
4.化学实验中有时需要将某些溶液或试剂进行酸化,下列酸化方法正确的是
 A.检验C2H5Cl中的氯元素:先将C2H5CI与NaOH溶液混合后加热,再加盐酸酸化
A.检验C2H5Cl中的氯元素:先将C2H5CI与NaOH溶液混合后加热,再加盐酸酸化
 B.提高KmnO4溶液的氧化能力:用盐酸将KmnO4溶液酸化
B.提高KmnO4溶液的氧化能力:用盐酸将KmnO4溶液酸化
 C.鉴定溶液中是否有Fe2+:先将溶液用硝酸酸化,再加入KSCN溶液
C.鉴定溶液中是否有Fe2+:先将溶液用硝酸酸化,再加入KSCN溶液
 D.检验溶液中是否有SO42-:先将溶液用足量的盐酸酸化,再加人BaCl2溶液
D.检验溶液中是否有SO42-:先将溶液用足量的盐酸酸化,再加人BaCl2溶液
 5.下列说法中正确的是
5.下列说法中正确的是
 ①非金属氧化物一定不是碱性氧化物 ②电解质溶液的导电过程中必然要发生化学变化
①非金属氧化物一定不是碱性氧化物 ②电解质溶液的导电过程中必然要发生化学变化
 ③盐酸既有氧化性又有还原性
④Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备
③盐酸既有氧化性又有还原性
④Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备
 ⑤S02能使酸性高锰酸钾溶液褪色,所以它具有漂白性
⑤S02能使酸性高锰酸钾溶液褪色,所以它具有漂白性
 A.②③ B.①②③ C.①②③④ D.①②③⑤
A.②③ B.①②③ C.①②③④ D.①②③⑤
 6.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法中不正确的是
6.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法中不正确的是
 A.CaO2的水解产物是Ca(OH)2和H2O2
B.(CH3)3COMgBr的水解产物是(CH3)3COH和Mg(OH)Br
A.CaO2的水解产物是Ca(OH)2和H2O2
B.(CH3)3COMgBr的水解产物是(CH3)3COH和Mg(OH)Br
 C.PCl3的水解产物是PH3和HClO
D.A1(C2H5)3的水解产物是Al(OH)3与C2H6
C.PCl3的水解产物是PH3和HClO
D.A1(C2H5)3的水解产物是Al(OH)3与C2H6
 7.下列有关描述中不正确的是
7.下列有关描述中不正确的是
 A.在所有氧化还原反应中,氧化剂的氧化性一定强于氧化产物的氧化性
A.在所有氧化还原反应中,氧化剂的氧化性一定强于氧化产物的氧化性
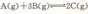 B.反应 达平衡后,温度不变,增大压强,平衡正向移动但平衡常数K不变
B.反应 达平衡后,温度不变,增大压强,平衡正向移动但平衡常数K不变
 C.在KI溶液中加入氯化银固体,一段时间后沉淀变成黄色,说明同温度下KSP(AgI)<KSP(AgCI)
C.在KI溶液中加入氯化银固体,一段时间后沉淀变成黄色,说明同温度下KSP(AgI)<KSP(AgCI)
 D.常温下硝酸铵溶于水是一个能自发进行的吸热过程,说明该过程的△S>0
D.常温下硝酸铵溶于水是一个能自发进行的吸热过程,说明该过程的△S>0


 8.镁及其化合物一般无毒、无污染,且镁电池放电时电压高而平稳,使镁成为人们研制绿色电池的焦点之一。某种镁电池的工作原理为 ,有关该电池放电时的下列说法中错误的是
8.镁及其化合物一般无毒、无污染,且镁电池放电时电压高而平稳,使镁成为人们研制绿色电池的焦点之一。某种镁电池的工作原理为 ,有关该电池放电时的下列说法中错误的是
 A. Mg2+向正极移动
B.正极反应为Mo3 S4+2xe-
=====M03S42x-
A. Mg2+向正极移动
B.正极反应为Mo3 S4+2xe-
=====M03S42x-
 C.Mo3S4发生氧化反应
D.负极反应为xMg一2xe- ====xMg2+
C.Mo3S4发生氧化反应
D.负极反应为xMg一2xe- ====xMg2+
 二、不定项选择题:本题包括6小题,每小题4分,共24分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该小题为。分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。
二、不定项选择题:本题包括6小题,每小题4分,共24分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该小题为。分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。
 9.下列实验一定可以获得预期效果的是
9.下列实验一定可以获得预期效果的是
 A.用饱和碳酸钠溶液除去CO2中的少量HCI
B.用溴水除去混在苯中的少量苯酚
A.用饱和碳酸钠溶液除去CO2中的少量HCI
B.用溴水除去混在苯中的少量苯酚
 C.用质谱法测定有机物的相对分子质量
D.用湿润的pH试纸测定溶液的pH
C.用质谱法测定有机物的相对分子质量
D.用湿润的pH试纸测定溶液的pH
21.下表是元素周期表的一部分。
 族
周期 族
周期 |
I A |
II A |
III A |
IV A |
V A |
VI A |
VII A |
|
一 |
|
|
|||||
|
二 |
a |
|
|
b |
d |
|
e |
|
三 |
|
f |
g |
|
|
h |
j |
(1)表中元素的单质中熔点最高的可能是___(填元素符号);写出a的氯化物的电子式 ;e、f、h形成的简单离子的半径由大到小顺序依次为______________(填离子符号);
(2)在一定条件下,j与d可形成一种化合物,常温下为淡黄色液体,则其晶体类型为__;该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种物质具有漂白性,写出相关反应的化学方程式___________________________;
(3)现有一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,该元素是表中____________元素(填编号);
(4)在g的单质中添加f单质,形成物质k,则g、f、k中硬度最大的是_____(填物质名称)。
(5)若制得117号元素,按元素周期表中金属与非金属的分区,它应是一种
(选填“金属”“非金属”)元素,写出117号元素最外层电子排布式 。
(6)试用短周期元素,写出两种中心原子杂化轨道类型不同的AB3型分子的化学式
、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com