
1.某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是
可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合
金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。
上述说法正确的是
A. ①②③④ B.①②⑤⑥ C.③⑤⑥⑦ D.①③④⑦
37. 18.4g的NaOH和NaHCO3固体混合物,在密闭容器中加热到约250℃,经充分反应排出气体、冷却,称得剩余固体质量为16.6g(13.5g)。试计算原混合物中NaOH的质量分数?
36.叠氮化合物应用广泛,如NaN3,可用于汽车安全气毂,PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件Ph-代表苯基 )
)
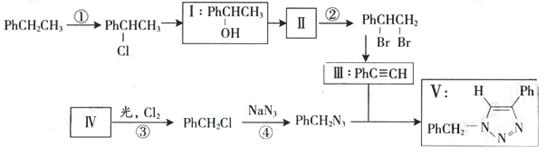
(1)下列说法不正确的是____________(填字母)
A.反应①④属于取代反应 B.化合物I可生成酯,但不能发生氧化反应
C.一定条件下化合物II能生成化合物I
D.一定条件下化合物II能与氢气反应类型与反应②相同
(2)化合物II发生聚合反应的化学方程式为_____________________________________
(不要求写出反应条件)
(3)反应③的化学方程式为_________________________________(要求写出反应条件)
(4)化合物III与PhCH2N3发生环加成反应成化合物V,不同条件下环加成反应还可生成化合物V的同分异构体。该同分异物的分子式为__________结构式为______________。
(5)科学家曾预言可合成C(N3)4。其可分解成单质,用作炸药。有人通过NaN3与NC-CCl3,反应成功全成了该物质下列说法正确的是___________(填字母)
A.该合成反应可能是取代反应
B.C(N3)4与甲烷具有类似的空间结构
C.C(N3)4不可能与化合物Ⅲ发生环加成反应
D.C(N3)4分解爆炸的化学反应方程式可能为C(N3)4 C+6N2
C+6N2
35.超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超Al2O3,NH4AlO(OH)HCO3热分解的化学反应方程式
__________________________________________________________________________
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mlpH为2浓度约为0.1mol·L-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2·12H2O固体_________g
②将上述固体置于烧杯中____________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________
(3)在0.1mol·l-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图
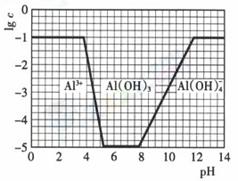
用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有
_________________________________________________________________________
34.甲酸甲酯水解反应方程式为:
HCOOCH3(l)+H2O(l)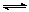 HCOOH(l)+CH3OH(l);△H>0
HCOOH(l)+CH3OH(l);△H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
|
组分 |
HCOOCH3 |
H2O |
HCOOH |
CH3OH |
|
物质的量/mol |
1.00 |
1.99 |
0.01 |
0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
|
反应时间范围/min |
0~5 |
10~15 |
20~25 |
30~35 |
40~45 |
50~55 |
75~80 |
|
平均反应速率 /(10-3mol·min-1) |
1.9 |
7.4 |
7.8 |
4.4 |
1.6 |
0.8 |
0.0 |
请计算15-20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:________
__________________________________________________________________________
(3)上述反应的平衡常数表达式为: ,则该反应在温度T1下的K 值为 。
,则该反应在温度T1下的K 值为 。
33.有A、B、C、D、E、F、G7瓶不同物质的溶液,它们各是KCl、MgCl2、Na2SO4、Na2CO3、
AgNO3、 Ca(NO3)2、Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,
实验结果如表所示。表中“↓”表示生成沉淀或微溶化合物,“一”表示观察不到明显
变化。试回答下面问题:
(1)A的化学式是 ,G的化学式是 。判断理由是
________________________________________________________________________
(2)写出其余几种物质的化学式B C D E F________
|
|
A |
B |
C |
D |
E |
F |
G |
|
A |
- |
- |
- |
- |
- |
- |
↓ |
|
B |
- |
- |
- |
- |
↓ |
↓ |
↓ |
|
C |
- |
- |
- |
↓ |
- |
↓ |
↓ |
|
D |
- |
- |
↓ |
- |
↓ |
↓ |
↓ |
|
E |
- |
↓ |
- |
↓ |
- |
↓ |
- |
|
F |
- |
↓ |
↓ |
↓ |
↓ |
- |
↓ |
|
G |
↓ |
↓ |
↓ |
↓ |
? |
↓ |
? |
32.在配制物质的量浓度溶液时,下列操作出现的后果是( “偏低” “偏高””无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。
(2)配制氢氧化钠溶液时,溶液不能澄清,溶质少量不溶解。____________。
(3)配制氯化钠溶液时,容量瓶中有少量水。______________。
(4)定容时,液面上方与刻度相齐时,停止加水。__________。
(5)配制好溶液后,容量瓶未塞好,洒出一些溶液。_____________。
(6)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线____________。
31.配制250 mL 1.6mol/L NaCl溶液。具体步骤如下:
⑴计算:需 gNaCl。
⑵称量:使用的主要仪器是 。
⑶溶解:将称好的NaCl放在 中加适量蒸馏水溶解,并用 加以搅拌。
⑷转移:待溶液冷却到室温后,将其沿玻璃棒注入 中,其中玻璃棒的作
用是 。
⑸洗涤:将烧杯和玻璃棒用蒸馏水洗涤 次,并将每次洗涤后的溶液都注入中 ;其主要目的是 。
⑹定容:将蒸馏水注入 中,直到其中液面接近其刻度 处时,改用 ______________滴加蒸馏水至溶液的 液面正好与刻度线相切。将瓶塞子盖好,反复上下颠倒、摇匀。
30.⑴2gNaOH溶于水配制成 mL溶液时其物质的量浓度为2mol/L。
⑵现欲配制200mL0.2mol/L Na2SO4溶液,则需要用 mL 1mol/L的Na2SO4溶液加水稀释而成。从稀释而成的溶液中取出10 mL则其中含有的钠离子是 个。
⑶把标况下2.24LHCl气体溶于水,配制成250mL溶液,则该溶液的物质的量浓度
为 ,若其密度为1.1g/mL,则其溶质的质量分数是 %。
29.⑴标准状况下:22g CO2的体积是 ,其中所含分子数与 gO2相同。
⑵0.01 mol某气体的质量是0.28g,该气体的摩尔质量是 ;在标准状况下,该气体的密度是 。
⑶相同条件下,CH4与O2的质量比是1:8时二者的体积比是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com