
11.下列离子方程式正确的是
A.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:
Ca2++2HCO3-+2OH- = CaCO3↓+CO32-+2H2O
C.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O ==2HCO3-+SO32-
D.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑
10.难溶物氢化亚铜(CuH)可用CuSO4溶液和“另一种反应物”在40℃~50℃时反应生成。CuH不稳定,易分解;CuH在氯气中能燃烧;常温下跟盐酸反应能产生气体,以下有关它的推断中不正确的是
A.“另一种反应物”一定具有氧化性 B.CuH既可做氧化剂也可做还原剂
C.CuH+Cl2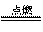 CuCl+HCl↑ D.CuH+HCl==CuCl↓+H2↑
CuCl+HCl↑ D.CuH+HCl==CuCl↓+H2↑
9.设阿伏加德罗常数为NA。则下列说法正确的是
A.常温常压下,18.0 g重水(D2O)中所含的电子数为10 NA
B.1cm3铁所含的铁原子数是ρ·NA/56(ρ是铁的密度,单位为g·cm-3)
C.2.24LCO2与足量的Na2O2反应,Na2O2转移的电子总数一定为0.1NA
D.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
8.A、B、C、D都是短周期元素,原子半径:D>C >A >B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。下列说法中正确的是
A.A、C两元素处在元素周期表中的第ⅥA族
B.B、C、D三种元素可组成化学式为DCB2的化合物
C.B、D两元素组成的化合物中阴、阳离子的个数比为1∶1
D.B、C、D三种元素的简单离子的半径大小顺序为:C > D > B
7.1986年,人们成功的用如下反应制得了氟:
①2KMnO4+2KF+10HF+3H2O2=2K2MnF6+8H2O+3O2
②K2MnF6+2SbF5=2KSbF6+MnF4
③2MnF4=2MnF3+F2↑
下列说法中正确的是
A.反应①、②、③都是氧化还原反应
B.反应①H2O2既是还原剂又是氧化剂
C.氧化性:KMnO4>O2
D.每生成1mol F2,上述反应共转移2mol电子
6.在指定环境中,下列各组离子可以大量共存的是
A.使pH试纸呈红色的溶液中:Fe2+、NO3-、SO42-、Na+
B.滴加无色酚酞试液后仍无色的溶液中:CO32-、K+、ClO-、AlO2-
C.在c(H+)/c(OH-)= 1×1013的溶液中:NH4+、Ca2+、C1-、K+
D.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42-
5.下列排列的顺序正确的是
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③碱性:Mg(OH)2>Al(OH)3>Li OH
④结合质子能力:CO32->HCO3->SO42-
A.①③ B.②④ C.①④ D.②③
4.下列实验方案能达到目的的是
A.除去Fe粉中混有的I2:加热使I2升华
B.除去NaCl固体中混有的MgCl2:加入KOH溶液后过滤,滤液蒸发结晶
C.除去碳酸钠中混有的碳酸氢钠:加入过量的氢氧化钠溶液,蒸发结晶
D.除去氢氧化镁中混有的氢氧化钙:放入水中搅拌成浆状后,加入足量氯化镁溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
3.分类是化学研究中常用的方法。下列分类方法中,不正确的是
A.根据元素原子最外层电子数的多少将元素分为金属和非金属
B.依据有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
C.根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
D.依据组成元素的种类,将纯净物分为单质和化合物
2.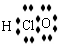 下列化学用语表达正确的是
下列化学用语表达正确的是
A.HClO的电子式:
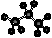
B.丙烷分子的比例模型:
C.Ar原子的结构示意图: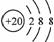
D.北京奥运会奖牌--“金镶玉”奖牌玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO·5MgO·8SiO2·H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com