

3、与实验推断结合考查Fe(OH)2的制备、Fe2+与Fe3+的检验等知识,以铁元素的转化关系
考查化学方程式的计算。
[知识链接]
回忆初中有关金属在空气中燃烧、与酸反应的方程式
[学法指导]
合作探究、自主归纳
[学习内容]
知识点一:钠及其化合物
A级 写出有关钠及其化合物的所有化学方程式。
思考1:如何取用金属钠?请叙述具体操作步骤。将金属钠放入水中,有何现象?
思考2: ⑴Na2O2是不是碱性氧化物?为什么?
⑵为什么Na2O2常用于航天航海事业?用方程式加以说明。
思考3:如何鉴别Na2CO3、NaHCO3?
填空:碱金属元素的原子结构的共同点:原子的最外层均为 个电子,都易 1个电子而表现 性;
不同点:核电荷数逐渐 ;电子层数逐渐 ;原子半径依次 ,得电子能力逐渐 ;单质还原性逐渐 。
B级 1.将金属钠块放在燃烧匙里加热,对其实验现象有如下描述, 其中正确的是
(1)钠在燃烧之前先熔化 (2)在空气中燃烧有黄色火花四射 (3)燃烧后得到白色固体
(4)燃烧时火焰呈黄色 (5)燃烧后生成物为淡黄色固体
A.只有(5) B.只有(1) C.(1)(4) 5) D.(2)(3)
2、Al2O3、Al(OH)3的两性及Al3+、Al(OH)3、AlO2-间的转化关系,结合Al(OH)3的制备实验、计算及在生产生活中的应用进行综合考查
1、以实验探究、框图推断考查钠及其重要化合物的综合应用
21.(10分)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜单质的质量分数为x,试回答下列问题。
(1)所得硫酸铜晶体的质量y为: g(用x表示);
(2)若x =0.4,混酸中HNO3与H2SO4的物质的量之比为: ;
(3)若x=0.4时,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数(写出计算过程)。
20.(8分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
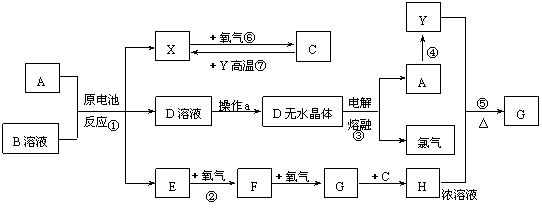
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
19.(12分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
该工艺的主要流程如下。
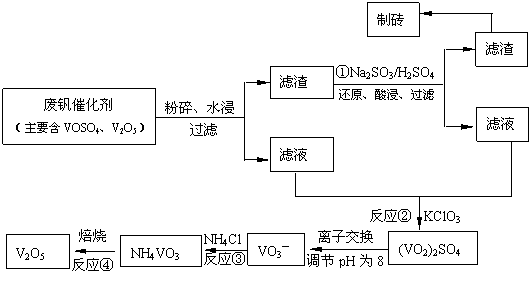 请回答下列问题:
请回答下列问题:
(1)23V在元素周期表位于第 周期 族。工业上由V2O5 冶炼金属钒常用铝热剂法,其用化学方程式表示为 。
(2)反应①的目的是 。
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量: VO2+ + H2C2O4 + H+ → VO2+ + CO2 + ______。
短线上填写物质的化学式或离子符号后,写出配平后完整的离子方程式。
。
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中 。
A.先分解失去H2O,再分解失去NH3
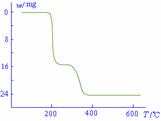 B.先分解失去NH3,再分解失去H2O
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
18.(12分)A-J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
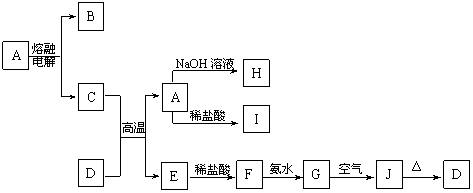 请回答下列问题:
请回答下列问题:
(1)A的化学式为 。
(2)H溶液中通入过量的CO2,其反应的离子方程式是 。
G→J的化学方程式为 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因 。
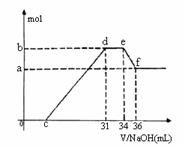 (4)现有一定量C、E混合物与稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。坐标图c点溶液中溶质除C和E的硝酸盐外,还含有的溶质是______________________,其对应物质的量为
。
(4)现有一定量C、E混合物与稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。坐标图c点溶液中溶质除C和E的硝酸盐外,还含有的溶质是______________________,其对应物质的量为
。
17.(10分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A、D同主族,C、E同主族,D、E、F同周期。A、B的原子最外层电子数之和与C原子的最外层电子数相等。 A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A-F六种元素原子,原子半径最大的是 (填对应的元素符号,下同)。
(2)A与B两种元素组成一种阳离子,该离子的结构式为 。
(3)C、D两种元素组成的化合物中,既含有离子键,又含有非极性共价键,该化合物的电子式为 。
(4)E、F两种元素中非金属性强的是 ;能够证明这一结论的化学事实是 。
16.(8分)5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式: 。
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是 。
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中氧化剂与还原剂的物质的量之比为 。
21.(10分)
(1)质量y为: g(用x表示); (2)物质的量之比为: ;
(3)解:
并加入少量铁粉;
③配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏低;
④用瓷坩埚熔化各种钠的化合物;
⑤分液时,先从分液漏斗中倒出上层液体,后放出下层液体;
⑥测溶液大致的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照;
⑦ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同;
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积前者少,后者多。
Ⅱ、镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:
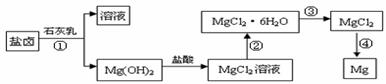
回答下列问题:
(1) 工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是
。
(2) 从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经 、
 (填操作方法)可得纯净的Mg(OH)2。
(填操作方法)可得纯净的Mg(OH)2。
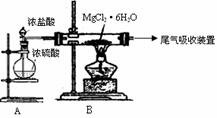
(3)下图是该兴趣小组设计进行过程③的实验装置图:
其中装置A的作用是 。
(4)写出过程④中发生反应的化学方程式
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com