
6.下列关于性质递变规律的叙述,不正确的是:
A.还原性Na>Mg>Al B.非金属性Cl>S>P
C.酸性H2SO4>H3PO4>HClO4 D.稳定性HCl>H2S>PH3
5.下列物质属于离子化合物是
A.SO2 B.H2O C.NaCl D.HCl
4.下列物质的分子中,不含共价键的是
A.NaCl B.Cl2 C.HCl D.NaOH
3.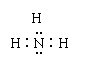
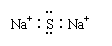
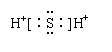 下列物质的电子式书写正确的是
下列物质的电子式书写正确的是
|
 C.
D.
C.
D.2.元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
1.“铱星”计划中的铱的一种同位素是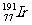 ,其核内中子数与质子数之差是
,其核内中子数与质子数之差是
A.77 B.114 C.191 D.37
5.(09天津卷 7)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
7)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
 (4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
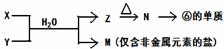
 X溶液与Y溶液反应的离子方程式为
X溶液与Y溶液反应的离子方程式为
_____________________________________,
 N→⑥的单质的化学方程式为
N→⑥的单质的化学方程式为
_____________________________________.
 常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
[学习反思]
第5课时练习 物质结构 元素周期律
编制人:江相成 审核人:杨德豪 包科领导:杨德豪
4.已知短周期元素的离子aA2+、bB+、cC3-、dD一都具有相同的电子层结构,则下列叙述正确的是
A.原子半径A>B>C>D B.原子序数a>b>c>d
C.离子半径C3->D一>B+>A2+ D.单质的还原性A>B>D>C
3.下列对于核素的说法中正确的是
A.核素是指质量数相同的微粒 B.核素是指质子数相同、中子数不同的微粒
C.核素是指具有一定数目的质子和一定数目的中子的一种原子
D.核素是指质子数相同、核外电子数不同的微粒
2.《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,
在470℃、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com