
11.近来研究认为松果体分泌物--“退黑素”(英文名称melatonin,简称MLT)与人的寿命长短有关、有人把“退黑素”和克隆技术并称为“二十世纪生命科学的两大发现”。退黑索的化学结构简式为:
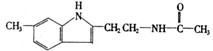
(1)退黑素的分子式为
(2)退黑素结构简式中,虚线框内的结构名称为 ,它在稀硫酸中受热后生成的具有酸性的物质为 。
45.下表是元素周期表的一部分,回答下列有关问题:
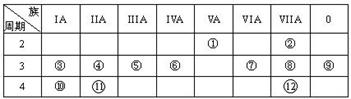
(1)写出下列元素符号:① ______,⑥ ______,⑦ __ __。
(2)画出原子的结构示意图:④___ __ ___,⑧___ 。
(3)在①~12元素中,金属性最强的元素是_____,非金属性最强的元素是______,最不活泼的元素是____。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 (填序号),跟它同周期原子半径最小的元素是 (填序号),它们可以形成 (填离子或共价)化合物,用电子式表示其形成过程如下:
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程:
44.制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。人们曾采用过乙醚、NH3、CH3Cl等作制冷剂,但他们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的制冷剂。据现有知识,某些元素化合物的燃性、毒性变化趋势如下:
(l)氢化物的易燃性:第二周期 > >H2O、HF;第三周期SiH4>PH3> >
(2)化合物的毒性:PH3>NH3 H2S H2O;CS2 CO2 CCl4>CF4(选填>或<)。于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.9℃,CF4的沸点为-128℃,新制冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的制冷剂氟里昂CF2Cl2终于诞生了,其他类似的还可以是 。然而,这种制冷剂造成了当今的某一环境问题是 。
43.有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出五种元素的名称:A B C D E 。
(2)用电子式表示离子化合物A2B的形成过程:
(3)写出下列物质的电子式:
D元素形成的单质 ;B与E形成的化合物 ;
A、B、E形成的化合物 ;D、E形成的化合物 。
42.(09重庆卷29)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
⑴X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 。
⑵X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为
⑶一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为 ;Z分子的结构呈
②A的化学式是
⑷X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是
41.某元素的同位素AZM,它的氯化物MCl 1.17g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有12个中子,则
(1)Z= ,A= ;
(2)M元素在周期表中的位置 ;
(3)把M的单质在空气中燃烧,写出反应的化学方程式 。
40.已知有1H216O、D2S、3H218O、S17O2、2H2S、S16O2,其中有_________种元素, 种原子,
种分子。
39.某阳离子Mn+ 的核外共有x个电子,核内有a个中子,则M的质量数为
A.a+x-n B.a+x+n C.a-x-n D.a-x+n
38.关于离子键、共价键的各种叙述中,下列说法中正确的是
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
D.由不同元素组成的含多个原子的分子里,一定只存在极性键
37.关于元素周期表的下列叙述,错误的是
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一。
B.在周期表中,把电子层数相同的元素排成一横行,称为一周期
C.元素周期表中,总共有18个纵行,18个族
D.第IA族的元素又称为碱金属元素(除了H),第VIIA族的元素又称为卤族元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com