
5.某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是
A.Na+、K+、Cl-、SO42- B.Cu2+、Fe2+、NO3-、SO42-
C.Na+、Ca2+、Cl-、ClO- D.K+、NH4+、Cl-、SO42-
4.从石英砂制取并获得高纯硅的主要化学反应如下:
① SiO2+2C Si(粗)+2CO
Si(粗)+2CO
② Si(粗)+2Cl2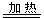 SiCl4
SiCl4
③ SiCl4+2H2 Si(纯)+4HCl
Si(纯)+4HCl
关于上述反应的分析不正确的是
A.①、③是置换反应,②是化合反应
B.高温下,焦炭与氢气的还原性均强于硅
C.任一反应中,每消耗或生成28 g硅,均转移4 mol电子
D.高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅
3.下列有关实验的说法正确的是
A.将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体
B.测量溶液的导电性可区分出试剂盐酸和醋酸,导电能力强的是盐酸
C.做完银镜反应后的试管可用热的稀硝酸清洗,回收后的硝酸银溶液可再利用
D.除去硫酸铝溶液中混有的硫酸镁,可加入足量烧碱,过滤,向滤液中加入适量硫酸酸化
2.下列表示物质结构的化学用语或模型正确的是
A.8个中子的碳原子的核素符号:12C B.HF的电子式: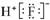
C.Cl-离子的结构示意图: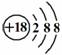 D.CH4分子的比例模型:
D.CH4分子的比例模型:
1.2007年诺贝尔化学奖获得者德国科学家格哈德·埃特尔在表面化学研究领域作出了开拓性贡献。化学家将研究气体与固体(或液体)在界面上所发生的物理化学现象的科学称为表面化学。对下列现象的研究不属于表面化学范畴的是
A.氯化银在水中的溶解平衡 B.氢氧燃料电池中电极上的反应
C.铁在潮湿的空气中生锈 D.氮气与氢气在铁触媒作用下化合
21.(10分)Cu、Cu2O和CuO组成的混合物,加入100ml0.6mol/LHNO3溶液恰好使混合物溶解,同时收集到224mLNO气体(标准状况)。求:
⑴写出Cu2O跟稀硝酸反应的离子方程式______________________________________
⑵产物中硝酸铜的物质的量_____________
⑶如混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量分别为_______ _______
⑷如混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围
_______________ ________________ ______________________________
20.(14分)元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①-⑨九种元素在周期表中的位置。
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
⑤ |
|
⑥ |
|
|
|
3 |
① |
③ |
④ |
|
|
|
⑦ |
⑨ |
|
4 |
② |
|
|
|
|
|
⑧ |
|
请回答:
⑴写出下列元素符号① 、⑥ 、⑦ ,九种元素中化学性质
最不活泼的是 。
⑵在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式)。
⑶①、③、④三种元素按原子半径由大到小的顺序依次为 (填元素符号)。
⑷⑥元素的氢化物是 (填化学式),该氢化物在常温下与①发生反应的化学
方程式为 ,所得溶液的pH (填“<”、“>”或“=”)7。
⑸①元素与⑦元素形成的化合物是 (填化学式),高温下灼烧该化合物时,火焰
呈 色。
⑹用电子式表示出⑤⑦两种元素构成的化合物的形成过程 。
19.(10分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。⑴冶炼铜的反应为 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液 d.用浓硫酸吸收
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
18.(10分)多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
|
|
卤素 |
氰 |
硫氰 |
① |
|
“单质” |
X2 |
(CN)2 |
(SCN)2 |
(OCN)2 |
|
酸 |
HX |
HCN |
② |
HOCN |
|
盐 |
KX |
KCN |
KSCN |
③ |
⑴在表中①②③空格处应分别填写_______、_______、_______。
⑵完成下列反应的化学方程式或离子方程式。
①(CN)2和KOH溶液反应的化学方程式为:___________________________________。
②已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:___________________________________。
17.(10分)(1)配制0.1mol·L-1的NaOH溶液时,下列操作会导致实际浓度偏高的是 .
A.使用的砝码部分生锈 B.定容时俯视容量瓶的刻度线
C.选用的容量瓶内残留有少量蒸馏水
D.定容、摇匀后,发现液面低于刻度线,再加水至刻度线
(2)按要求填空:
①用已准确称量的1.06gNa2CO3固体配制0.100mol·L-1 Na2CO3溶液100mL,所需要的仪器为 .
②除杂:FeCl2溶液(FeCl3)(用离子方程式表示)____________________________
③除杂:Fe(Al)(用化学方程式表示)______________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com