
3.

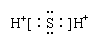 下列物质的电子式书写正确的是
下列物质的电子式书写正确的是
|
 C.
D.
C.
D.2.元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
1.“铱星”计划中的铱的一种同位素是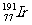 ,其核内中子数与质子数之差是
,其核内中子数与质子数之差是
A.77 B.114 C.191 D.37
26、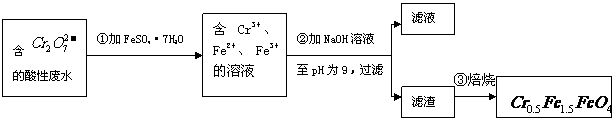
 (09安徽卷27)(12分)
(09安徽卷27)(12分) 某厂废水中含5.00×10-3mol·L-1的
某厂废水中含5.00×10-3mol·L-1的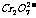 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料 (
(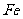 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:






 (1)第①步反应的离子方程式是
(1)第①步反应的离子方程式是
 (2)第②步中用PH试纸测定溶液PH的操作是:
(2)第②步中用PH试纸测定溶液PH的操作是:
 (3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
 (4)欲使1L该废水中的
(4)欲使1L该废水中的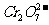 完全转化为
完全转化为 。理论上需要加入
。理论上需要加入
 gFeSO4·7H2O。
gFeSO4·7H2O。
25、 (09上海卷24)某反应中反应物与生成物有:
(09上海卷24)某反应中反应物与生成物有: 、
、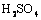 、
、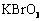 、
、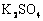 、
、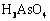 、
、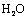 和一种未知物质X。
和一种未知物质X。
 (1)已知
(1)已知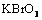 在反应中得到电子,则该反应的还原剂是
。
在反应中得到电子,则该反应的还原剂是
。
 (2)已知0.2mol
(2)已知0.2mol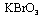 在反应中得到1mol电子生成X,则X的化学式为
。
在反应中得到1mol电子生成X,则X的化学式为
。
 (3)根据上述反应可推知
。
(3)根据上述反应可推知
。
 a.氧化性:
a.氧化性: b.氧化性:
b.氧化性: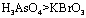
 c.还原性:
c.还原性: d.还原性:
d.还原性: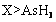

 (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:

24、 (09广东化学23)
(09广东化学23) 磷单质及其化合物的有广泛应用。
磷单质及其化合物的有广泛应用。
 由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
 4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)  H
H
 (1)①上述反应中,副产物矿渣可用来
。
(1)①上述反应中,副产物矿渣可用来
。
 ②已知相同条件下:
②已知相同条件下:
 4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) 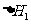
 2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)
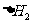
 SiO2(s)+CaO(s)=CaSiO3(s)
SiO2(s)+CaO(s)=CaSiO3(s)

 用
用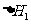 、
、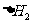 和
和 表示
表示 H
H ,
, H
H =
=
 (2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为
。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为
。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为

 (3)次磷酸钠(NaH2PO2)可用于化学镀镍。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
 ①NaH2PO2中P元素的化合价为
。
①NaH2PO2中P元素的化合价为
。
 ②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
 (a) Ni2+ + H2PO2-+ → Ni + H2PO3 -+
(a) Ni2+ + H2PO2-+ → Ni + H2PO3 -+
 (b)6H2PO2-
+2H+ = 2P+4H2PO3-+3H2↑
(b)6H2PO2-
+2H+ = 2P+4H2PO3-+3H2↑
 请在答题卡上写出并配平反应式(a)。
请在答题卡上写出并配平反应式(a)。
 ③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
 方法上的不同点:
;原理上的不同点:
;化学镀的优点:
。
方法上的不同点:
;原理上的不同点:
;化学镀的优点:
。
23、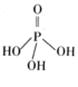 (2006湖北一联)向盛有400mL某浓度稀HNO3的大烧杯中加入Wg铁粉,充分反应后,铁粉质量减少16.8g,再往烧杯中加入V mL 4 mol·L-1的稀硫酸,充分反应后,铁粉质量又减少8.4g,此时铁粉仍有剩余,(假设稀HNO3只被还原为NO)
⑴写出题中铁粉与稀HNO3反应的离子方程式___________________________________,通过计算得出所用的稀HNO3的物质的量浓度为_______________ mol·L-1,加稀H2SO4之前,溶液中剩余的NO3-的物质的量为___________mol。
(2006湖北一联)向盛有400mL某浓度稀HNO3的大烧杯中加入Wg铁粉,充分反应后,铁粉质量减少16.8g,再往烧杯中加入V mL 4 mol·L-1的稀硫酸,充分反应后,铁粉质量又减少8.4g,此时铁粉仍有剩余,(假设稀HNO3只被还原为NO)
⑴写出题中铁粉与稀HNO3反应的离子方程式___________________________________,通过计算得出所用的稀HNO3的物质的量浓度为_______________ mol·L-1,加稀H2SO4之前,溶液中剩余的NO3-的物质的量为___________mol。
⑵加入4 mol·L-1的稀硫酸的体积V=_______________________
⑶若硫酸足量,要使反应有H2产生,W的取值范围是___________________。
22、(2008天津高考)(1)配平氧化还原反应方程式:
__C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。 ①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。 ②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。 ③原试样中H2C2O4·2H2O的质量分数为___。KHC2O4的质量分数为___。
21、用双线桥标出电子转移的方向和数目,并指出氧化剂和还原剂
⑴FeTi03+3H2SO4=Ti(SO4)2+FeSO4+3H2O
⑵ 2Na2O2 + 2CO2 = 2Na2CO3 + O2
20、写出下列有关反应的离子方程式
⑴氯化铝溶液中加过量的NaOH溶液_____________________________________________
⑵向NaOH溶液中加氧化铝_____________________________________________________
⑶向稀硝酸中加过量的铁粉___________________________________________________
⑷氯气、二氧化硫1:1通入水中________________________________________________
⑸澄清石灰水中加过量NaOH溶液_______________________________________________
⑹澄清石灰水中通过量的CO2___________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com