

2. 在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH值都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得等量的氢气。下列说法正确的是:
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大;
B.甲烧杯中的酸过量;
C.两烧杯中参加反应的锌等量;
D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小。
1.

 (09年全国2) 现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
(09年全国2) 现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是

 A.
④①②⑤⑥③
B. ④①②⑥⑤③
A.
④①②⑤⑥③
B. ④①②⑥⑤③

 C.
①④②⑥③⑤
D. ①④②③⑥⑤
C.
①④②⑥③⑤
D. ①④②③⑥⑤
7. 25ºC,若10体积的某强碱溶液与1体积的某强酸溶液混合后,溶液呈中性,则混合之前,
该碱的pH与强酸的pH之间该满足的关系是_______________________
[答案]a+b=13
[解析]由题意知,本题为酸、碱混合后完全中和,根据中和反应的实质可知,酸中n(H+)与碱中n(OH-)相等,故有C(H+)酸V酸 == C(OH-)碱V碱,由此关系列式可求得结果。
[解答]设酸的pH为a,C(H+)酸=10-a,碱的pH为b,C(OH-)碱=10-14 /
10-b=10- (14 - b) 因为混合后溶液呈中性,所以C(H+)酸V酸 == C( )碱V碱
)碱V碱
10-a ×V = 10 - (14 - b) ×10V = 10 - (13 - b) ×V
10-a = 10 - (13 - b)
两边取负对数:-lg10-a = -lg10 - (13 - b),a=13-b a+b=13
即酸的pH与碱的pH之和为13
[典例精析]
例1. 某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C( ) = ___________。
) = ___________。
若温度不变,滴入稀盐酸使C(H+)
= 5×10-6 mol/L,则此时溶液中的C( ) = ___________。
) = ___________。
[解析]由水电离产生的H+与OH-量始终相等,知纯水中C(H+)
= C( )。根据纯水中
)。根据纯水中
C(H+) 与C( )可求出此温度下水的Kw的值,由Kw的性质(只与温度有关,与离子浓度无关),若温度不变,稀盐酸中Kw仍为此值,利用此值可求出盐酸中的C(
)可求出此温度下水的Kw的值,由Kw的性质(只与温度有关,与离子浓度无关),若温度不变,稀盐酸中Kw仍为此值,利用此值可求出盐酸中的C( )。
)。
[答案]纯水中 C( ) = C(H+)
= 2×10-7 mol/L
) = C(H+)
= 2×10-7 mol/L
Kw = C(H+)·C( ) = 2×10-7×2×10-7
= 4×10-14
) = 2×10-7×2×10-7
= 4×10-14
稀盐酸中 C( ) = Kw / C(H+)
= (4×10-14) / (5×10-6) = 8×10-9 mol/L
) = Kw / C(H+)
= (4×10-14) / (5×10-6) = 8×10-9 mol/L
例2. 把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
A.C(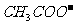 )>C(Na+)
)>C(Na+)
B.C(CH3COOH)>C(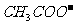 )
)
C.2C(H+)=C(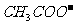 )-C(CH3COOH)
)-C(CH3COOH)
D.C(CH3COOH)+
C(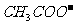 )=0.01mol/L
)=0.01mol/L
[解析]此题实质上是0.05mol/L的CH3COOH溶液和0.05mol/L的CH3COONa溶液的混合溶液。由电荷守恒关系可得: c(H+)+c(Na+)=c(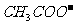 )+c(OH-) (1)
)+c(OH-) (1)
由物料守恒关系可得: c(CH3COOH)+c(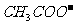 )=c(Na+)×2=0.01mol/L (2)
)=c(Na+)×2=0.01mol/L (2)
由(2)可知D正确。将(1)×2+(2)可得:2c(H+)=c(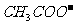 )+2c(OH-)-c(CH3COOH)(3)C选项错误21世纪教育网
)+2c(OH-)-c(CH3COOH)(3)C选项错误21世纪教育网
[答案]D
例3. 下列叙述正确的是
A.0.1mol·L-1氨水中,c( )==c(NH4+)
)==c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c( )==c(CH3COOH)+c(H+)
)==c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)==2c(A2-)+c(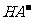 )+c(H2A)
)+c(H2A)
[解析]NH3·H2O是弱电解质,它本身电离所产生的两种离子浓度相等,得氨水中的部分 来自于H2O的电离,所以c(OH-)>c(NH4+),A错;B项中酸碱中和反应后,
来自于H2O的电离,所以c(OH-)>c(NH4+),A错;B项中酸碱中和反应后,
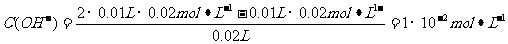
pH=-lgC(H+)=-lg(10-14/10-12)=12,B正确;根据盐的消解规律,可以判断C正确;D项中因钠元素的离子与A原子的物质的量之比为1∶1,对应关系应该为c(Na+)=c(A2-)+c(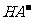 )+c(H2A),D错。
)+c(H2A),D错。
[答案]BC
 例4.(09年天津)下列叙述正确的是
例4.(09年天津)下列叙述正确的是
 A. 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
A. 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
 B. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
B. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
 C. pH=5的CH3COOH溶液和Ph=5的NH4Cl溶液中,c(H+)不相等
C. pH=5的CH3COOH溶液和Ph=5的NH4Cl溶液中,c(H+)不相等
 D. 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D. 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
[解析]A项,苯酚钠为碱性溶液,故错;B项,温度不变,则Kw是不变的,错;C项,pH=5即代表溶液中C(H+)均为10-5mol/L,错。D项,Ag2S比AgCl更难溶,故加入S2-会与溶液中的Ag+结合的,正确21世纪教育网
[答案]D
例5.(09年全国1) 用0.1
mol•.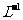 的盐酸滴定0.10 mol•.
的盐酸滴定0.10 mol•.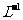 的氨水,滴定过程中不可能出现的结果是
的氨水,滴定过程中不可能出现的结果是
A.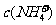 >
>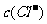 ,
,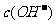 >
>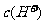 B.
B. 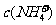 =
=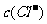 ,
,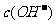 =
=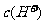
C.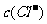 >
>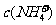 ,
,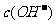 >
>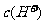 D.
D. 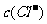 >
>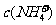 ,
,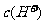 >
>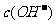
[解析]溶液中不可能出现阴离子均大于阳离子的情况,不遵循电荷守恒,故C项错。
[答案]C
 例6.(09年福建)在一定条件下,Na2CO3溶液存在水解平衡:
例6.(09年福建)在一定条件下,Na2CO3溶液存在水解平衡:
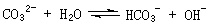 。下列说法正确的是
。下列说法正确的是
 A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
 C. 升高温度,
C. 升高温度,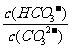 减小
D. 加入NaOH固体,溶液PH减小
减小
D. 加入NaOH固体,溶液PH减小
[解析]平衡常数仅与温度有关,故稀释时是不变的,A项错;CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确;升温,促进水解,平衡正向移动,故表达式的结果是增大的,C项错;D项,加入NaOH,碱性肯定增强,pH增大,故错。
[答案]B
 例7.(09年安徽) 向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
例7.(09年安徽) 向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
 A. Va>Vb时:c (CH3COOH) +c (CH3COO-)>c
(K+)
A. Va>Vb时:c (CH3COOH) +c (CH3COO-)>c
(K+)
 B. Va=Vb时:c (CH3COOH) +c (H+)>c
(OH-)
B. Va=Vb时:c (CH3COOH) +c (H+)>c
(OH-)
 C. Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H)
C. Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H)
 D. Va与Vb任意比时:c (K+)+ c (H+)
=c (OH-)+ c (CH3COO-)
D. Va与Vb任意比时:c (K+)+ c (H+)
=c (OH-)+ c (CH3COO-)
 [解析]若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,则A选项正确;若Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;若Va<Vb,说明碱过量,当碱液加的量足够多,则可以存在c(K+)>c(CH3COO-),C选项错误;D选项符合电荷守恒,正确。
[解析]若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,则A选项正确;若Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;若Va<Vb,说明碱过量,当碱液加的量足够多,则可以存在c(K+)>c(CH3COO-),C选项错误;D选项符合电荷守恒,正确。
 [答案]C
[答案]C
 例8.(09年广东) 下列浓度关系正确的是
例8.(09年广东) 下列浓度关系正确的是
 A. 氯水中:c(Cl2)=2[c(
A. 氯水中:c(Cl2)=2[c(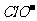 )+c(
)+c(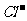 )+C(HClO)]
)+C(HClO)]
 B. 氯水中:c(
B. 氯水中:c(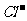 )>c(
)>c(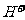 )>c(
)>c(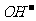 )>c(
)>c(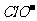 )
)
 C. 等体积等浓度的氢氧化钠与醋酸混合:c(
C. 等体积等浓度的氢氧化钠与醋酸混合:c(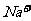 )=c(
)=c(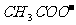 )
)
 D.
D. 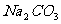 溶液中:c
溶液中:c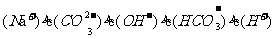
 [解析]根据氯水中所含粒子的种类可知氯水中也含有氯气分子A设置了一个貌似物料守恒的式子而忽视了氯气分子的存在,故A错;根据Cl2+H2O
[解析]根据氯水中所含粒子的种类可知氯水中也含有氯气分子A设置了一个貌似物料守恒的式子而忽视了氯气分子的存在,故A错;根据Cl2+H2O HClO+H++
HClO+H++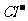 ,HCl完全电离 而HClO部分电离,可知正确的顺序c(H+)>c(
,HCl完全电离 而HClO部分电离,可知正确的顺序c(H+)>c(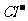 )>c(
)>c(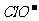 )>c(
)>c( ),B错;C项等物资的量的强碱与弱酸混合生成强碱弱酸盐溶液显碱性c(
),B错;C项等物资的量的强碱与弱酸混合生成强碱弱酸盐溶液显碱性c(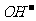 )>c(
)>c(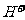 ),再根据溶液中电荷守恒可以判断c(
),再根据溶液中电荷守恒可以判断c(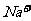 )>c(
)>c(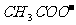 );D项比较简单
);D项比较简单
 [答案]D
[答案]D
例9.已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法正确的是 ( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
[解析]0.1 mol·L-1的强酸pH=1.0,0.1 mol·L-1的H2A溶液pH=4.0,说明它是一种弱酸。Na2A发生水解A2-+H2O HA-+OH-和HA-+H2O
HA-+OH-和HA-+H2O H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA发生水解HA-+H2O
H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA发生水解HA-+H2O H2A+OH-和电离HA-
H2A+OH-和电离HA- H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
物质的量相等的Na2A和NaHA因为存在上述水解、电离等过程,阴离子数量发生变化,所以阴离子总量不相等,B不正确。
由电荷守恒可知c(Na+)+c(H+)=c(HA-)+c( )+2c(A2-),C正确。Na2A溶液显碱性,c(
)+2c(A2-),C正确。Na2A溶液显碱性,c( )>c(H+),D不正确21世纪教育网
)>c(H+),D不正确21世纪教育网
[答案]C
例11. 用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是( )
A. c(OH-)/c(NH3·H2O)
B. c(NH3·H2O)/c( )
C.
c(H+)和c(
)
C.
c(H+)和c( )的乘积
D. OH-的物质的量
)的乘积
D. OH-的物质的量
[解析]加水稀释,一方面溶液中所有的微粒的浓度都会同等程度地降低;另一方面氨水的电离平衡将向电离的方向移动,即产物降低的幅度小一点,反应物降低的幅度大一点;随着电离平衡向电离的方向移动, 的数目或物质的量还是比稀释前要多。
的数目或物质的量还是比稀释前要多。
[答案] B
例12. Fe(OH)3难溶于水,存在平衡:Fe(OH)3 Fe3++3
Fe3++3 ,在Fe(OH)3悬浊物中加入少量下列物质后,可使溶液中的Fe3+浓度增大的是
,在Fe(OH)3悬浊物中加入少量下列物质后,可使溶液中的Fe3+浓度增大的是
A.NaOH溶液 B.稀HCl C.稀HI D.水
[解析:]A项增大了 浓度,使平衡向逆反应方向移动;B项消耗
浓度,使平衡向逆反应方向移动;B项消耗 ,使平衡向正向移动;C项既消耗
,使平衡向正向移动;C项既消耗 ,
,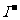 又能与Fe3+发生氧化还原反应;D项的平衡尽管向正向移动,但溶液中所有的微粒浓度都会降低。
又能与Fe3+发生氧化还原反应;D项的平衡尽管向正向移动,但溶液中所有的微粒浓度都会降低。
[答案] B。
例13.下列说法正确的是
A. 相同温度下,1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中,c(OH-)之比是2:1
B. 0.1 mol·L-1 NH4Cl溶液中的c(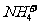 )=c(
)=c(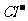 )
)
C. 向0.1 mol·L-1NaNO3 溶液中滴加稀盐酸,使溶液pH=1,此时混合液中c(Na+)=c(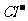 )
)
D. 向醋酸钠溶液中加入适量醋酸,使 混合液的pH=7,此时混合液中c(Na+)=c(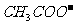 )
)
[解析]A项中如果是强碱,其浓度之比与 浓度之比相等,但此处氨水是弱碱,稀氨水的电离程度大,所以二者的
浓度之比相等,但此处氨水是弱碱,稀氨水的电离程度大,所以二者的 浓度之比小于2:1;B项中如果是强酸强碱盐,不发生水解,则等式成立,但NH4Cl中的
浓度之比小于2:1;B项中如果是强酸强碱盐,不发生水解,则等式成立,但NH4Cl中的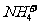 水解后,消耗OH-、积累H+,c(
水解后,消耗OH-、积累H+,c(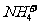 )<c(
)<c(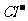 )。C项中NaNO3和HCl都是强电解质,完全电离为离子,满足己知条件要求。D项中pH=7,c(H+)=C(
)。C项中NaNO3和HCl都是强电解质,完全电离为离子,满足己知条件要求。D项中pH=7,c(H+)=C(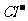 ),根据电荷守恒:C(H+)+C(Na+)=C(
),根据电荷守恒:C(H+)+C(Na+)=C( )+C(
)+C(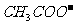 ),即得答案。
),即得答案。
[答案]CD21世纪教育网
例14. 取pH值均等于2的盐酸和醋酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸和醋分别与锌反应的速度一样大
[解析] 影响生成氢气多少的是酸最多提供的n(H+)的多少,而与其浓度大小无关;影响生成氢气速率大小的是酸己电离的c(H+)大小,而与其物质的量多少无关。
n(HCl)=0.01×0.1=0.001mol ,n (Zn)=0.03/65=0.00046 mol , n(CH3COOH)> 0.01mol。由反应关系来看,两酸均过量,则产生同样多的氢气。
PH=2的两酸稀释相同倍数后,由于醋酸的继续电离,使得c(H+,CH3COOH)>c(H+,HCl),故醋酸产生氢气和速率大。
[答案]BC21世纪教育网
例15. 在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C.相同pH值的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH值变化大
D.相同pH值的盐酸和醋酸分别跟锌反应时,产生氢气的起始速度相等
[解析]A项中醋酸在稀释过程中电离程度加大,要想达到与盐酸一样的H+浓度,所需加水要多;B项中的醋酸不能用浓硫酸来制取;C项中HCl加NaCl不会使其电离有什么变化,因为它本来己经完全电离了,而醋酸中加醋酸钠,将会抑制醋酸的电离;D项中pH相同,c(H+)肯定相等,只能说明起始c(H+)相等,不能说明反应中有何变化。
[答案]AC。
例16. 难溶化合物的饱和溶液存在着溶解平衡,例如:
AgCl(s) 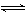 Ag++
Ag++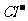 ,Ag2CrO4(s)
,Ag2CrO4(s)
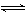 2Ag++
2Ag++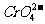 ,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][
,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][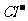 ]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[
]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[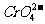 ]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)
]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1) 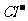 和
和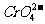 中哪种先沉淀?
中哪种先沉淀?
(2)当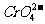 -以Ag2CrO4形式沉淀时,溶液中的
-以Ag2CrO4形式沉淀时,溶液中的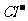 Cl-离子浓度是多少?
Cl-离子浓度是多少? 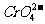 与
与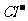 能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
[解析](1)当溶液中某物质离子浓度的乘积大于Ksp时,会形成沉淀。几种离子共同沉淀某种离子时,根据各离子积计算出所需的离子浓度越小越容易沉淀。(2)由Ag2CrO4沉淀时所需Ag+浓度求出此时溶液中Cl-的浓度可判断是否达到有效分离。
[答案](1)AgCl饱和所需 Ag+浓度[Ag+]1=1.8×10-7摩/升
Ag2CrO4饱和所需Ag+浓度[Ag+]2==4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[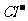 ]==4.13×10-6<10-5,所以能有效地分离。
]==4.13×10-6<10-5,所以能有效地分离。
 例17.(09年山东)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
例17.(09年山东)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g)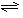 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)21世纪教育网
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)21世纪教育网
 (2)O2 (g)= O+2(g)+e-
(2)O2 (g)= O+2(g)+e-  H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
 PtF6(g)+ e-1
PtF6(g)+ e-1 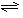 PtF6-(g)
PtF6-(g)  H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
 O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6-
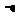 H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
 则反应O2(g)+ PtF6 (g) = O2+PtF6-
(s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6-
(s)的 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(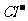 ),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________21世纪教育网
),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________21世纪教育网
 [解析](1)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动;催化剂仅是改变化学反应速率,不会影响焓变。(2)根据盖斯定律,将化学方程式①+②-③叠加。(3)Cu(OH)2 的Ksp小于Mg(OH)2的,所以离子的浓度商首先大于Cu(OH)2
的而先沉淀;由于氨水是弱碱,书写离子方程式时不能拆开。(4)由溶液的电荷守恒可得: c(H*)+c(
[解析](1)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动;催化剂仅是改变化学反应速率,不会影响焓变。(2)根据盖斯定律,将化学方程式①+②-③叠加。(3)Cu(OH)2 的Ksp小于Mg(OH)2的,所以离子的浓度商首先大于Cu(OH)2
的而先沉淀;由于氨水是弱碱,书写离子方程式时不能拆开。(4)由溶液的电荷守恒可得: c(H*)+c(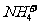 )=c(
)=c(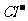 )+c(
)+c( ),已知c(
),已知c(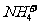 )=c(
)=c(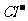 ),则有c(H*)=c(OH-),溶液显中性;电离常数只与温度有关,则此时NH3·H2O的电离常数Kb=
[c(
),则有c(H*)=c(OH-),溶液显中性;电离常数只与温度有关,则此时NH3·H2O的电离常数Kb=
[c(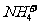 )·c(OH-)]/c(NH3·H2O)=
(0.01 mol·L-1·10-7mol·L-1)/(amol·L-1-0.01
mol·L-1)= 10-9/( (a-0.01)mol·L-1.
)·c(OH-)]/c(NH3·H2O)=
(0.01 mol·L-1·10-7mol·L-1)/(amol·L-1-0.01
mol·L-1)= 10-9/( (a-0.01)mol·L-1.
 [答案](1)向左 不改变 (2)-77.6 (3)Cu(OH)2 Cu2++2NH3·H2O=Cu(OH)2
↓+2
[答案](1)向左 不改变 (2)-77.6 (3)Cu(OH)2 Cu2++2NH3·H2O=Cu(OH)2
↓+2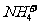
 (4)中 Kb=10-9/(
(a-0.01)mol·L-1.
(4)中 Kb=10-9/(
(a-0.01)mol·L-1.
[专题突破]
6. 以下是25℃时几种难溶电解质的溶解度:
|
难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶
② 为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶
③ 为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 而除去
(2)①中加入的试剂应该选择_________为宜,其原因是________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________________。
(4)下列与方案③相关的叙述中,正确的是__________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
[答案](1)氢氧化铁(2)氨水;不会引入新的杂质(3)2Fe3++3Mg(OH)2 == 3 Mg2+ +2Fe(OH)3 (4)A C D E
[解析]由于氢氧化铁相对于氢氧化亚铁溶解度小,沉淀所需要的PH值低,所以通常将Fe2+氧化为Fe3+然后再进行沉淀,沉淀中存在溶解平衡,所以当加入溶解度更小的沉淀剂时,沉淀会发生转化,因些加入氢氧化镁时会发生氢氧化镁溶解生成氢氧化铁沉淀,加入沉淀剂时一般不能引入新的杂质,所以加入时应该加入与溶液中主要离子相同的阴离子或阳离子,所以为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,然后可以加入含有氧化铜,氢氧化铜等物质21世纪教育网
规律:
(1)利用沉淀平衡实现沉淀而除杂时,常加入与溶液中主要离子相同阳离子的难溶物进行处理,如除去氯化镁中的铁离子,可以加入氧化镁、氢氧化镁、碳酸镁、碳酸氢镁等
(2)除杂时不能引入新的杂质离子,如:将Fe2+氧化为Fe3+时,只能用H2O2、O3等,若溶液中原有氯离子,还可以考虑用氯水等,但不能加入溶液中不含有的离子。
5.(2008年江苏高考第12题)下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) == c( ) + c(
) + c(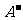 )
)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(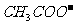 ) +2c(
) +2c( ) == 2c(H+)
+ c(CH3COOH)
) == 2c(H+)
+ c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(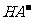 )>c(H+)>c(H2A)>c(A2-)
)>c(H+)>c(H2A)>c(A2-)
[答案]A、C
[解析]选项A中无论酸HA与碱MOH强还是弱,反应后的溶液中总存在四种离子,根据电荷守恒,A正确,选项B中NaOH是强碱,电离呈碱性,CH3COONa和Na2CO3两种溶液是水解呈碱性,水解的程度很小,若PH相同的,所需要两者的物质的量浓度远大于NaOH溶液,而且酸越弱水解的程度越大,所需要浓度就越小c(NaOH)<c(Na2CO3)<c(CH3COONa)
选项C中存在电荷守恒c(H+)
+ c(Na+) == c( ) + c(
) + c(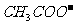 ),另不管溶液是电离还是水解,由于物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,所以2c(Na+) == c(CH3COOH) + c(
),另不管溶液是电离还是水解,由于物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,所以2c(Na+) == c(CH3COOH) + c(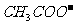 ),把后面的等式代入到第一个等式中,则C正确,D选项是溶液呈碱性,酸式盐的水解大于电离的等式若酸式盐呈碱性电离大于水解就不成立了,D错误
),把后面的等式代入到第一个等式中,则C正确,D选项是溶液呈碱性,酸式盐的水解大于电离的等式若酸式盐呈碱性电离大于水解就不成立了,D错误
规律:
(1)相同PH值的不同物质的浓度比较,若呈碱性则是强碱<弱碱<水解呈碱性的盐,水解程度大的盐<水解程度小的盐(呈酸性的顺序也可以同理推出)
(2)多元弱酸的酸式盐溶液NaHA,呈酸性与呈碱性时的不同是水解产物与电离产物的排序,还有就是H+与OH-的排序,如水解大于电离则c(H+)>c(H2A)>c(A2-),若电离大于水解则c( )>c(A2-)>c(H2A)。
)>c(A2-)>c(H2A)。
4.(2008年天津理综第9题)醋酸溶液中存在电离平衡:
CH3COOH H++CH3COO-,下列叙述不正确的是
( )
H++CH3COO-,下列叙述不正确的是
( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
[答案]B
[解析]根据电荷守恒,可得:c(H+)=c( )+C(
)+C(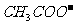 ),故A项对;0.1mol/lCH3COOH在加水稀释过程中酸性减弱,即c(H+)减小,而在一定温度下,C(H+)·C(
),故A项对;0.1mol/lCH3COOH在加水稀释过程中酸性减弱,即c(H+)减小,而在一定温度下,C(H+)·C( )=Kw是一定值,故c(
)=Kw是一定值,故c( )增大,所以B错;在醋酸中加入醋酸钠,c(
)增大,所以B错;在醋酸中加入醋酸钠,c(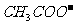 )增大,所以平衡向左移动,故C对;pH=2的CH3COOH中pH=12的NaOH中c(H+)=c(
)增大,所以平衡向左移动,故C对;pH=2的CH3COOH中pH=12的NaOH中c(H+)=c( ),但由于醋酸是弱酸,部分电离,故醋酸的物质的量浓度大于NaOH,二者等体积混合后,醋酸过量,所以溶液显酸性,即pH<7,所以D对21世纪教育网
),但由于醋酸是弱酸,部分电离,故醋酸的物质的量浓度大于NaOH,二者等体积混合后,醋酸过量,所以溶液显酸性,即pH<7,所以D对21世纪教育网
规律:
(1)弱酸在加入水稀释的过程中H+与弱酸根离子的浓度都在减小,只有对应的 浓度在增加(如果改成氨水讨论的方法相同)
浓度在增加(如果改成氨水讨论的方法相同)
(2)PH之和为14的酸与碱等体积混合后,若都是强的则呈中性,若有弱的溶液呈弱的一方的性质,(把选项D的溶液改为氨水与盐酸同样讨论,若使溶液呈中性则加入的弱的一方的体积应该少)
3. 质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、 、
、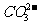 为失去质子后的产物,故有以下关系:C(H3O+)+C(H2CO3)=C(NH3)+C(
为失去质子后的产物,故有以下关系:C(H3O+)+C(H2CO3)=C(NH3)+C( )+C(
)+C(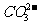 )。
)。
2. 物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nC(Na+):nC(C)=1:1,推出:C(Na+)=C(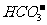 )+C(
)+C(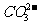 )+C(H2CO3)
)+C(H2CO3)
1. 电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:nC(Na+)+nC(H+)=nC(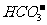 )+2nC(
)+2nC(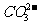 )+nC(
)+nC( )推出:C(Na+)+C(H+)=C(
)推出:C(Na+)+C(H+)=C(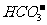 )+2C(
)+2C(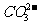 )+C(
)+C( )
)
3. 用物质的量都是0.1
mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(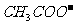 )>C(Na+),对该混合溶液的下列判断正确的是( )
)>C(Na+),对该混合溶液的下列判断正确的是( )
A.C(H+)>C( )
B.C(CH3COOH)+C(
)
B.C(CH3COOH)+C(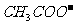 )=0.2 mol/L
)=0.2 mol/L
C.C(CH3COOH)>C(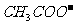 ) D.C(CH3COO-)+C(
) D.C(CH3COO-)+C( )=0.2 mol/L
)=0.2 mol/L
答案:B
方法要领: CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知C(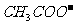 )>C(Na+),根据电荷守恒C(
)>C(Na+),根据电荷守恒C(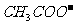 )+C(
)+C( )=C(Na+)+C(H+),可得出C(
)=C(Na+)+C(H+),可得出C( )<C(H+)。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于
)<C(H+)。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于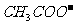 的水解趋势。根据物料守恒,可推出(B)是正确的21世纪教育网
的水解趋势。根据物料守恒,可推出(B)是正确的21世纪教育网
[规律总结]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com