
1.提出原子学说的科学家是
A.道尔顿
B.卢瑟福 C.汤姆生
D.玻尔
13、某课外学习小组设计如下的简易实验装置,证明在相同条件下,体积相同、物质的量浓度相同的两种强弱不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验条件下的气体摩尔体积。请回答下列问题:
⑴请将该实验的主要操作步骤补充完全:
①配制浓度均为1mol·L-1的盐酸和醋酸溶液;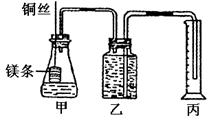
②用 量取10.00mL 1mol·L-1盐酸和醋酸分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带ag,并系于铜丝末端,a的数值要大于 。
④在广口瓶中装足量的水,按图连接好装置并检查装置的气密性。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录
和反应后量筒中水的体积。
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL。(包括导管里的水)
⑵本实验中应选用 (填序号)的量筒。
A.100mL B.200mL C.500mL
⑶若不计水蒸气的影响,在实验室条件下,气体摩尔体积的计算式为:Vm= L·mol-1
⑷简述速率不等的原因
⑸写出醋酸和镁带反应的离子方程式:
12、TOC时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6molA和3molB,发生反应:3A(g)+bB(g)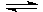 3C(g)+2D(g);△H<0,4min时甲容器内的反应恰好达到平衡,A的物质的量浓度为2.4mol/L,B的物质的量浓度为1.8mol/L,t min时乙容器内的反应达到平衡,B的物质的量浓度为0.8mol/L。回答下列问题:
3C(g)+2D(g);△H<0,4min时甲容器内的反应恰好达到平衡,A的物质的量浓度为2.4mol/L,B的物质的量浓度为1.8mol/L,t min时乙容器内的反应达到平衡,B的物质的量浓度为0.8mol/L。回答下列问题:
⑴甲容器中反应的平均速率V(B)= ,化学方程式中的计量系数b= 。
⑵乙容器中达平衡所需的时间t 4(填“大于”“小于”或“等于”)。
⑶TOC时,在另一体积和乙相同的丙容器中,为达到平衡时B的物质的量浓度仍为0.8mol/L,起始时,向丙容器内加入C、D的物质的量分别为3mol、2mol,则还需加入A、B的物质的量分别为 、 。
⑷若要使甲、乙容器内B的平衡浓度相等,可以采取的措施是 。
A、保持温度不变,增大甲容器的体积至2L
B、保持容器体积不变,使甲容器升高温度
C、保持容器压强和温度都不变,向甲容器中加入一定量的A气体
D、保持容器压强和温度都不变,向甲容器中加入一定量的B气体
D.奥赛一瞥
11、可逆反应:A+3B 2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是
( )
2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是
( )
A. ν(D)=0.4 mol / (L·s) B. ν(C)=0.5 mol / (L·s)
C. ν(B)=0.6 mol / (L·s) D. ν(A)=0.15 mol / (L·s)
10、在一定条件下,可逆反应N2 +3H2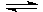 2NH3;ΔΗ<0;达到平衡,当单独改变下列条件后,有关叙述错误的是
( )
2NH3;ΔΗ<0;达到平衡,当单独改变下列条件后,有关叙述错误的是
( )
A.加催化剂V正V逆都发生变化且变化的倍数相等;
B..加压V正V逆都增大,且V正增大的倍数大于V逆增大的倍数;
C.降温V正V逆都减小, 且V正的减小倍数大于V逆减小的倍数;
D..加入氩气, V正V逆都增大, 且V正增大的倍数大于V逆增大的倍数.
9、反应2A(气) 2B(气)+C(气);ΔΗ> 0,在未用催化剂的条件下已达到平衡,现要使正反应速率降低,[B]减小,应采用的措施 (
)
2B(气)+C(气);ΔΗ> 0,在未用催化剂的条件下已达到平衡,现要使正反应速率降低,[B]减小,应采用的措施 (
)
A、升温 B、增大反应器体积 C、增大[A] D、降温
C.能力训练
8、若温度每升高10℃,反应速率增大到原来的2倍.10℃时某反应的速率为0.1 mol / (L·s),为了把该反应速率提高到1.6 mol / (L·s),其它条件不变时反应温度应是 ( )
A. 30℃ B. 40℃ C. 50℃ D. 60℃
7、酸性高锰酸钾溶液与草酸溶液反应的化学方程式为:
2KMnO4 + 3H2SO4 + 5H2C2O4 == K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
不能使反应速率加大的措施是( )。
A.增大酸性高锰酸钾溶液的浓度
B.增大草酸溶液的浓度
C.增大压强
D.升高温度
6、NO和CO都是汽车尾气里有害的物质,它们能缓慢地起反应生成N2和CO2,对此反应,下列叙述中正确的是 ( )
A、使用催化剂不能改变反应速率 B、降低压强能使反应速率加快
C、改变压强对反应速率没有影响 D、升高温度能加快反应速率
5、在恒温、恒容的密闭容器进行反应A(g) B(g)+C(g);ΔΗ> 0。若反应物的浓度由2mol/L降到0.8mol/L需要20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需要反应时间为
B(g)+C(g);ΔΗ> 0。若反应物的浓度由2mol/L降到0.8mol/L需要20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需要反应时间为
A、10 s B、大于10s C、小于10s D、无法判断
B.提高训练
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com