
3、非金属元素的性质及递变规律
(1)单质的熔沸点与聚集态:
①小分子物质。如H2、O2、N2、Cl2等,通常为气体,固体为分子晶体。
②多原子分子物质。如P4、S8、As等,通常为液态或固态,均为分子晶体,但熔、沸点因范德华力较大而比①高,Br2、I2也属此类,一般易挥发或升华。
③原子晶体类单质。如金刚石、晶体硅和硼等,是非金属单质中高熔点“三角区”,通常为难挥发的固体.
(2)单质导电性:
非金属一般属于非导体,金属是电的良导体,而锗、硅、砷、硒等属于半导体,石墨、碲属于电的良导体。
(3)单质的化学活性及反应

③非金属一般为成酸元素,难以与稀酸反应,固体非金属能被氧化性酸氧化。

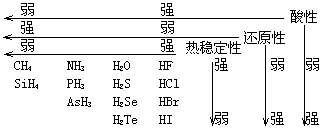 (4)氢化物
(4)氢化物
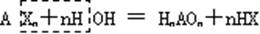
(5)卤化物:易水解
如 PCl3+3H2O=H3PO3+3HCl , SiCl4+3H2O=H2SiO3+4HCl
BCl3+3H2O=H3BO3+3HCl BrF5+3H2O=HBrO3+5HF
利用此法可制得氢卤酸和含氧酸
(6)含氧酸
① 同周期非金属元素最高价含氧酸从左到右酸性增强
② 氧化性:同种元素低价强于高价含氧酸
如: HClO>HClO3>HClO4(稀) H2SO3>H2SO4(稀) HNO2>HNO3(稀)
③氧化性酸与还原性酸
常见的强氧化性酸有:HNO3、浓H2SO4、HClO等。
常见的还原性酸有:H2SO3、H3PO3等。
HNO2既有氧化性,又有还原性,但以氧化性为主。
④某些酸的特殊性质
浓H2SO4:吸水性→做干燥剂;脱水性→使晶体脱结晶水,使有机物碳化。
HClO:漂白作用。漂白原理与Na2O2同,是利用强氧化性破坏有色物质。
H2SO3:漂白作用。与某些有色物质结合生成不稳定的无色物质,加热后恢复原色。
HF:与SiO2反应。SiO2+4HF→SiF4↑+2H2O
注意:酸的氧化性与氧化性酸是两个不同的概念。酸的氧化性就是指酸中H+结合电子的性质,凡酸皆有此性质。而氧化性酸是指含氧酸的中心元素结合电子的性质。
2、非金属元素在周期表中的位置及结构特点
(1) 除H外,非金属元素均在“金属与非金属分界线”的右上方。
(2) 非金属元素(包括稀有元素)均在主族(零族)。
(3) 最外层电子数一般≥4(H、B除外)
(4) 原子半径比同周期金属半径小(稀有元素除外)。
5.酸式盐的种类、性质、形成及其电离与水解。
 复习方法:(1)每族元素抓住代表物,重点讨论该元素的单质、氧化物、氢化物、酸、碱或盐等有关知识,并理清下列关系:
复习方法:(1)每族元素抓住代表物,重点讨论该元素的单质、氧化物、氢化物、酸、碱或盐等有关知识,并理清下列关系:
(2)运用元素周期表知识比较每族元素与其代表物在结构、性质上的相似性、递变性和特殊性。
4.碳族中碳、硅单质与氧化物的物理性质和化学性质,及其比较,碳酸和硅酸的性质对比碳酸盐与硅酸盐的相互转化及条件。
3.NH3、NO、NO2和硝酸的物理性质和化学性质;硝酸的实验室制法和工业制法。
2.H2S、硫的氧化物和硫酸的物理性质、化学性质,以及H2S和SO2的实验室制法。
1.卤族元素的原子结构,卤族元素的单质与化合物的性质及其速度规律。
1、非金属元素及其化合物知识是中学化学的核心和基础,它几乎贯穿在中学化学的各部分内容之中。这部分的知识要点有:
(二)理论指导:
建立和完善民主政治是社会主义制度健康发展的重要保障,请回答新中国成立到20世纪50年代中期中共是如何开创人民民主政治新局面的?(4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com