
13. 如图所示,在一密闭容器中间用一不漏气, 可滑动的活塞隔开,左边充洁净空气,右边充H2、O2混合气,在室温下引燃后恢复到原室温,若活塞原来离容器左端的距离为1/4(A)反应后活塞静止在离右端1/4处(B),求原来H2和O2的体积比。
如图所示,在一密闭容器中间用一不漏气, 可滑动的活塞隔开,左边充洁净空气,右边充H2、O2混合气,在室温下引燃后恢复到原室温,若活塞原来离容器左端的距离为1/4(A)反应后活塞静止在离右端1/4处(B),求原来H2和O2的体积比。
典例解析
[例1]Ge:第Ⅳ主族元素,最高正价+4;最高价氧化物GeO2。
Bi:第Ⅴ主族元素,最外层5个电子→满足8电子稳定结构应形成共价键数目:8-5=3→BiCl3→在BGO中铋为+3价→氧化物Bi2O3。
设BGO化学式为mGeO2·nBi2O3,则有:2m=3n m∶n=3∶2 m=3 n=2
故BGO化学式为3GeO2·2Bi2O3 (或Bi4(GeO4)3)
[例2]短周期元素中室温下常见的非金属单质中为气体的有H2、N2、O2、F2、Cl2 ,常见的固体单质有C、P、Si ,这些单质中式量最小的可能是H2。由图中转化关系可知,A+C→X,B+C→甲,A+D→Y,B+D→丙,X+甲→乙均为化合反应;Y+甲→丙+乙为复分解反应。5个化合反应中,A+D→Y的反应,涉及D物质必须“过量”,即若“不过量”,会生成其他物质。结合上述几种单质间能发生的反应,只有磷与Cl2或碳与O2才有可能,但当固体单质是碳时,其他转化关系不成立。再结合非金属卤化物易水解的性质,推测Y是PCl5,甲是水,则丙是HCl,乙为磷酸,D为Cl2,C为O2,A为磷,X为P2O5。
答案:(1)H3PO4 (2)2种(化合与复分解),5(3)O(O2与O3)、P(红磷与白磷)
[例3] ①Na2SO4、Na2CO3、Na2SiO3、Na2SO3
②取少量该溶液加入试管中,向其中加入稀盐酸。如果出现白色沉淀,则原溶液是Na2SiO3溶液;若产生无色、无味的气体,则原溶液是Na2CO3溶液;若产生无色、有刺激性气味的气体,则原溶液是Na2SO3溶液;若无明显现象出现,则说明为Na2SO4溶液。(本题为开放题,若有其它推测,且检验方案正确,均给分)
当堂反馈:1.C 2.A 3. C
12.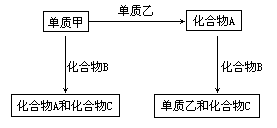 A、B、C是中学化学常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质,这些化合物和单质之间存在如下的关系:
A、B、C是中学化学常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质,这些化合物和单质之间存在如下的关系:
据此判断:
(1)在A、B、C这三种化合物中,
必定含有乙元素的是____(用A、B、C
字母填写)。
(2)单质乙必定是____(填“金属”或
“非金属”),其理由是__ __。
(3)单质乙的化学式可能是____,则化合物B的化学式是____。
11.2005年,我国成功发射了“神舟六号”载人飞船,“神舟六号”的成功发射对增强我国的国防力量和提高我国的国际地位都具有重要意义。
(1)肼(N2H4)是发射航天飞船常用的高能燃料。将NH3和NaClO按一定物质的量比混合反应,生成肼、NaCl和水,写出该反应的化学方程式:___________________;该反应中__________是氧化剂、____________是氧化产物。
(2)在火箭推进器中装有强还原剂肼和强还原剂过氧化氢,当它们混合时,即产生大量气体,并放出大量热。已知12.8g液态肼与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;1mol液态水变成1mol水蒸气需要吸收44kJ的热量。写出液态肼与过氧化氢反应生成液态水的热化学方程式:_______________________________________。
(3)若在宇宙飞船的太空实验室(失重条件下)进行以下实验,其中最难完成的是
A、将金粉和铜粉混合 B、将牛奶加入水中混合
C、蒸发食盐水制取食盐晶体 D、用漏斗、滤纸过滤除去水中的泥沙
(4)新型无机非金属材料在航天事业上有广泛应用。氮化硅陶瓷是一种重要的结构材料。氮化硅(Si3N4)晶体是一种超硬物质,耐磨损、耐高温。氮化硅晶体类型是_________;晶体中存在的化学键是_____________。
10.已知A、B、C、D是短周期中的4种非金属元素,它们的原子序数依次增大。A元素原子形成的离子就是一个质子。又知,①B单质在高温下可从A与D组成的某种化合物中置换出A,同时生成化合物BD,②A、C、D三种元素组成的某种盐水溶液显酸性,③B、C均能与D组成原子数比为1∶1和1∶2的化合物。
(1)写出①中反应的化学方程式__ ____。
(2)写出②中盐的水溶液显酸性的原因(写出离子方程式)___ ___。
(3)这四种元素可组成原子个数比4∶1∶2∶1(按A、B、C、D顺序)的化合物,其名称为__ __。这四种元素又可组成原子个数比为4∶1∶1∶2(按A、B、C、D顺序)的化合物,其结构简式为__ ____。
(4)C元素的气态氢化物能还原CuO,生成Cu、C单质及A与D形成的化合物,该反应的化学方程式为_ _____。
9.下列关系图中,A是一种正盐,D的分子量比C的式量大16,E是酸。当X无论是强酸还是强碱时都有如下转化关系(其它产物及反应所需条件均已删去):
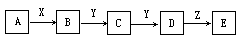
回答下列问题:
(1)A是____,Y是_____,Z是_____,
(2)当X是强酸时,A、B、C、D、E均合同一种元素,E是______,
(3)当X是强碱时,A、B、C、D、E均合同一种元素,E是______。
8.将水加入到下列物质中能发生反应,且有气体产生的是
①NaH ②Na2O ③Na2S ④Mg3N2 ⑤Al2S3 ⑥CaC2 ⑦NH4HCO3
A.①②⑤⑥⑦ B.①②④⑤⑥ C.①③④⑤ D.①②⑤⑥
7.下列有关工业生产的叙述中, 错误的是
A.制普通玻璃的主要原料是纯碱、石灰石、石英
B.氨是制作氮肥、硝酸、铵盐的重要原料
C.将二氧化硫催化氧化成三氧化硫后, 在吸收塔内用水吸收制得浓硫酸
D.炼铁的主要原理是在高温下, 用还原剂从铁矿石把铁还原出来
6.下列物质间发生化学反应:①H2S+O2,②Na+O2,③Cu+HNO3,④P2O5+H2O,⑤Fe+HCl。在不同条件下得到不同产物的是
A.①②③④ B.①③⑤ C.②③④⑤ D.①②③④⑤
5.汽车尾气中的CO、NO都是城市空气中浓度较高的严重污染物,有关它们的叙述不正确的是
A.CO、NO的燃烧产物分别是CO2和NO2
B.NO、NO2的混合气可与水反应生成一些HNO2,但NO、NO2都不是HNO2的酸酐
C.化学上有一种说法:等电子体结构类似。CO与NO+(亚硝酰基阳离子)的微粒中最外层电子数之和相等,应具有类似的结构
D.在催化剂作用下,可通过反应:2CO+2NO→N2+2CO2来达到净化汽车尾气的目的
4.磷化氢的分子式为PH3,又称为膦,是一种无色有类似大蒜气味的气体,剧毒,膦在空气中的着火点是150℃,下列叙述中正确的是
A.膦分子呈三角锥形,其中P-H键的键长要小于氨分子中 N-H 键的键长
B.膦的水溶液呈碱性,但其pH要比同浓度氨水的pH小
C.膦是一种还原性的气体,其还原性比氨气的还原性要强
D.化合物PH4I是一种很稳定的晶体,在受热时不分解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com