
3、外界因素对可逆反应正逆反应速率的影响:
[练4] 把下列四种X溶液分别加入四个盛有10ml,2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是 ( )
A.10℃ 20mL 3mol/L的X溶液 B.20℃ 30mL 2molL的X溶液 C.10℃ 10mL 4mol/L的X溶液 D.20℃ 10mL 2mol/L的X溶液
[练5] 铁片和稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是 ( )
A.加热 B.改用98%浓硫酸 C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
[练6]某反应在催化剂的作用下,按下列方式进行,第一步:2X+Y=2Z;第二步:Z+M=X+N。则下列说法正确的是 ( )
A. Z是催化剂,M是中间产物 B. X是催化剂,化学方程式为M+Y=N
C. X是催化剂,化学方程式为2M+Y=2N D. 无法判断催化剂和中间产物
知识点三-工业合成氨条件的选择---寻找较以较高的速率获得适当转化率的条件
|
反应特点 |
适宜的条件 |
选择依据 |
|
可逆反应 △H 0 气体分子数 |
温度: |
|
|
压强: |
|
|
|
催化剂: |
|
|
|
其他: |
|
[典型例题分析]
[例1]等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是

A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
[例2]反应C(s)+ H2O(g)  CO(g)+ H2(g) 在一可变容积密闭容器中进行,下列条件改变对反应速率几乎无影响的是
( )
CO(g)+ H2(g) 在一可变容积密闭容器中进行,下列条件改变对反应速率几乎无影响的是
( )
A、增加碳的量 B、将容器体积缩小一半
C、保持温度体积不变,充入氦气 D、保持温度压强不变,充入氦气
[例3]废旧印刷铜电路板的回收利用可实现资源再生,并减少污染。
(1) 用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq) = Cu2+(aq)+H2(g) △H = 64.39KJ·mol-1
2H2O2(l) = 2H2O(l) + O2(g) △H = -196. 46KJ·mol-1
2H2(g) + O2(g) = H2O(l) △H= -571.68KJ·mol-1
在H2SO4溶液中Cu与H2O2 反应生成Cu2+ 和H2O的热化学方程式为 。
(2)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3 .0 mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 (×10-3 mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主是
。
[巩固训练]
2.外因:(1)浓度对化学反应速率的影响:
☞改变固体的量不会改变化学反应速率;用V= kC(A)C(B) 解释 k为速率常数
(2)温度对化学反应速率的影响:
☞用阿伦尼乌斯公式解释:Ea > 0 时,升高温度,反应速率常数 ,反应速率 。
(3)压强对化学反应速率的影响是通过改变浓度实现的,对于只有固体、液体参与的反应压强对速率没有影响。具体有以下几种情况: Ⅰ、恒温:体积减小→增加压强→浓度增大→反应速率加快;反之减慢。 Ⅱ、恒温、恒容:充入气体反应物→压强增大→浓度增大→反应速率加快;反之减慢。 充入稀有气体→压强增大,但各物质浓度不变→反应速率不变。 Ⅲ、恒温、恒压:充入稀有气体→压强不变→体积增大→各物质浓度减小→反应速率减慢。
(4)催化剂增大化学反应速率的原因 ,
☞催化剂的特点:
(5)影响化学反应速率的因素还有光、电磁波、超声波、反应物颗粒的大小、溶剂的性质等
1.内因:反应物的结构与性质。
13.V(H2):V(O2)=16:11或19:8
12. (1)A、B(2)非金属;因为A+B→乙+C,且乙为单质,可知乙元素在A、B中分别显正、负价,所以乙是非金属。(3)S(或N2)H2S(或NH3)
11.(1)2NH3+NaClO=N2H4+NaCl+H2O NaClO N2H4
(2)N2H4(l)+2H2O2(l)=N2(g)+4H2O(l);△H=-817.625KJ/mol (3) D
(4)原子晶体 共价键
10.(1)C+H2O(气)→CO+H2(2)NH4++H2O→NH3·H2O+H+
(3)尿素H4NOOC-COONH4(4)3CuO+2NH3→3Cu+N2+3H2O
9.(1)(NH4)2S O2 H2O(2)H2SO4 (3)HNO3
5.(1)Cl(或氯) K(或钾)
(2)Cl2+2KOH=KCl+KClO+H2O
(3)2KClO3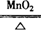 2KCl+3O2↑
2KCl+3O2↑
课后练习:1.B 2.A 3.C 4.C 5.A 6.A 7.C 8.B
4.(1)H2(2)2F2+2H2O==4HF+O2↑
(3)若D为N2,丙、丁分别是NH3和NO,在一定条件下可以反应(NH3、NO中N元素的化合价分别是-3、+2,0价居其中);若D为C,丙、丁分别是CH4与CO2,化合价分别是-4、+4,0价居其中,故理论上也可发生反应生成碳单质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com