
1. 若向量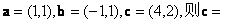

A.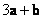 B.
B.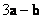 C.
C.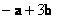 D.
D.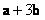

9、 答案:
答案:


 解析:
解析:
 本题考查化学反应速率和化学平衡的综合运用,注意图像和有关计算。
本题考查化学反应速率和化学平衡的综合运用,注意图像和有关计算。
 (1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
(1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
 (2)根据题意,可以利用“三步法”求解
(2)根据题意,可以利用“三步法”求解

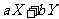
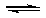
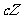
 开始
1.00
1.00
0
开始
1.00
1.00
0
 转化
0.45 0.9 0.9
转化
0.45 0.9 0.9
 平衡
0.55
0.1
0.9
平衡
0.55
0.1
0.9
 根据各物质的量之比可得体系中发生反应的化学方程式是:
根据各物质的量之比可得体系中发生反应的化学方程式是:
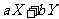
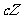 。
。
 (3)根据图像可知在3min时,生成物Z的物质的量为0.5mol, 其平均速率为0.083mol/L·min。
(3)根据图像可知在3min时,生成物Z的物质的量为0.5mol, 其平均速率为0.083mol/L·min。
 (4)X的转化率等于0.45。
(4)X的转化率等于0.45。
 (5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压。
(5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压。

 例二答案:
例二答案:
(1)BD
 (2)Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
(2)Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
 (3)H2O2
分解速率加快
(3)H2O2
分解速率加快
 (4)2Cu2++SO32-+2Cl-+H2O
(4)2Cu2++SO32-+2Cl-+H2O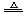 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
 解析:
解析:
(1)有关环保的比较容易。
(2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。
(3)考察影响化学反应速率的因素,结合双氧水的性质即可得出答案。
(4)根据题目条件书写离子方程式常规题。
6、答案:D
解析:从表中数据看,①④中CH3COCH3,HCl的浓度是相同的,而④中Br2比①中的大,所以结果,时间变长,即速率变慢了,D项错。其他选项依次找出表中两组相同的数据,看一变量对另一变量的影响即可。
7. 
 某温度时,在 2L 密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化 如表所示。
某温度时,在 2L 密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化 如表所示。
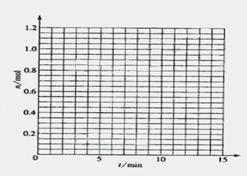

 (1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |

 (2) 体系中发生反应的化学方程式是___________________________;
(2) 体系中发生反应的化学方程式是___________________________;


 (3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;

 (4) 该反应达到平衡时反应物X的转化率
(4) 该反应达到平衡时反应物X的转化率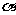 等于___________________________;
等于___________________________;

 (5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:

 ① _________ ②______ _ ③____________
① _________ ②______ _ ③____________
6、100mL6mol/L H2SO4跟过量锌粉反应,一定温度如下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
A.碳酸钠固体 B.醋酸钠固体C.硫酸钾溶液 D.硫酸铵固体
5.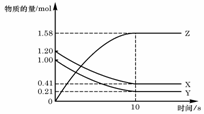 一定温度下,在 2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是( )
一定温度下,在 2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是( )
A.反应开始到10s,V(Z)== 0.158 mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)
 Z(g)
Z(g)
4.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)
 Si(s)+4HCl(g);
Si(s)+4HCl(g);
△H=+QkJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
3.(09福建卷 12)某探究小组利用丙酮的溴代反应(
12)某探究小组利用丙酮的溴代反应(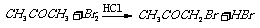 )
)
来研究反应物浓度与反应速率的关系。反应速率V(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
|
实验序号 |
初始浓度 C(mol·L-1 ) |
溴颜色消失所需时间 t / s |
||
|
CH3COCH3 |
HCl |
Br2 |
||
|
1 |
0.80 |
0.20 |
0.0010 |
290 |
|
2 |
1.60 |
0.20 |
0.0010 |
145 |
|
3 |
0.80 |
0.40 |
0.0010 |
145 |
|
4 |
0.80 |
0.20 |
0.0020 |
580 |
 分析实验数据所得出的结论不正确的是
分析实验数据所得出的结论不正确的是
 A. 增大c(CH3COCH3),V(Br2)增大 B. 实验②和③的V(Br2)相等
A. 增大c(CH3COCH3),V(Br2)增大 B. 实验②和③的V(Br2)相等
 C. 增大c(HCl) V(Br2)增大
D. 增大C(Br2),V(Br2)增大
C. 增大c(HCl) V(Br2)增大
D. 增大C(Br2),V(Br2)增大
2.(09年山东理综·14)2SO2(g)+O2(g)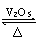
 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
A.催化剂V2O5不改变该反应的逆反应速率 B.增大反应体系的压强、反应速度一定增大
B.增大反应体系的压强、反应速度一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,SO3(g)生成的平均速率为V=(C2-C1)/(t2-t1)
1.设反应C+CO2 2CO ΔH>0,反应速率为v1,平衡常数为K1;
2CO ΔH>0,反应速率为v1,平衡常数为K1;
N2+3H2 2NH3 ΔH<0,反应速率为v2 ,
平衡常数为K2。对于上述反应,当温度升高时,v1、v2、K1、K2的变化情况为
( )
2NH3 ΔH<0,反应速率为v2 ,
平衡常数为K2。对于上述反应,当温度升高时,v1、v2、K1、K2的变化情况为
( )
A.v1、v2、K1、K2同时增大 B.v1、v2、K1、K2同时减小
C.v1、v2增大,K1增大,K2减小 D.v2减小,v1增大,K1增大,K2减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com