
15.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li
 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性 B.放电时电池内部Li+向负极移动.
C.充电过程中,电池正极材料的质量减少 D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
14.用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
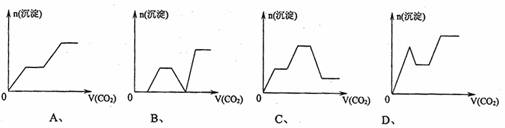
13.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
12.下列实验事实与所列出的相应结论正确的是 ( )
|
|
实验事实 |
结论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
CO2溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:H2CO3>Al(OH)3 |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属:P>N |
11. 25℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是 ( )
25℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是 ( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
10.能正确表示下列反应的离子方程式是 ( )
A.氯气跟水反应:Cl2+H2O→2H++Cl-+ClO-
B.硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO2-4→BaSO4↓
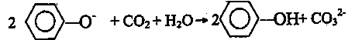 C.苯酚钠溶液中通入少量二氧化碳:
C.苯酚钠溶液中通入少量二氧化碳:
D.硫化亚铁跟盐酸反应:FeS+2H+→Fe2++H2S↑
8.下列各组离子,在指定的环境中一定能大量共存的是 ( )
A.由水电离出的C(H+)=1×10-12mol/L的溶液中:I-、CI-、HCO-3、Na+
B.在强酸性溶液中:Na+、S2-、NO-3、CO2-3
C.含大量Fe3+溶液中:K+、Cl-、NO-3、Na+
D.在加入铝粉能产生大量H2的溶液中:NH+4、Fe2+、SO2-4、Cl-
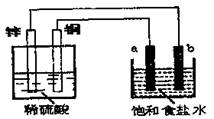 9.如右图,a、b是两根碳棒。以下叙述不正确的是 ( )
9.如右图,a、b是两根碳棒。以下叙述不正确的是 ( )
A.a是阳极.电极反应式为2Cl--2e→Cl2↑
B.铜上产生无色气体,a上产生有刺激性气味的气体
C.饱和食盐水中滴加酚酞试液的现象:b极附近溶液颜色变红;烧杯溶液中离子的浓度
变化是:C(Zn2+)变大,C(H+)变小
D.铜片上的电极反应式是:Cu2++2e→Cu
7.下列排列顺序正确的是 ( )
①沸点:H2S>H2O ②氧化性:Cu2+>Fe3+>H+>Fe2+
③原子半径:Na>Mg>O ④还原性:F>CI->S2-
⑤结合H+的能力:OH->CH3COO->CI-
A.①③④ B.②③ C.③⑤ D.②③⑤
6. 一定条件下,可逆反应C(s)+CO2(g) 2CO(g)-Q,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物c的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是( )
一定条件下,可逆反应C(s)+CO2(g) 2CO(g)-Q,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物c的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是( )
A.①②③④ B.①③ C.④② D.①③④
5.用NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A.4g重水(D2O)中所含质子数为0.2NA
B.4.48L,N2与CO的混合物所含分子数为0.2NA
C.含10.6g溶质Na2C03的溶液中,所含阳离子总数为大于0.2NA
D.12.5mL 16mol/L浓硫酸与足量铜反应,转移电子数为0.2NA.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com