
7.下图展示了现代国际关系中一次重要的大国较量。下列关于此事件叙述不正确的是( )
A.发生在两极格局正式确立后 B.全面冷战下的局部“热战”
C.苏联核力量弱势下的一次争锋 D.美苏经过谈判结束危机
6.二战以后,世界政治格局发生了巨大变化。下图《对德国的分区占领》产生的主要背景是( )
A.以美国为首的北约组织成立 B.以苏联为首的华约组织成立
C.美苏“冷战”局面逐步加剧 D.德国分裂为民主德国和联邦德国
5.下图是“二战”后初期苏联的一幅宣传漫画,从图中我们可以得到的正确信息是( )
A.古巴导弹危机中美苏双方的激烈对抗
B.苏联揭示了“二战”后美国和平政策的虚伪性
C.是美国对“华约”组织的挑战
D.苏联对马歇尔计划的应对
4.观察下图,对图中“善意”的正确理解是( )
①扶持控制西欧 ②援助欧洲发展 ③建立北约组织 ④遏制苏联力量
A.①②④ B.①②③ C.②③④ D.①③④
3.北约与华约组织的共同之处是 ( )
A.都是由大国控制的政治军事集团 B.都是帝国主义性质的大国集团
C.都是政治经济一体化的集团 D.都是由欧洲国家结成的地域性集团
2.不同社会制度的国家为了发展经济而组成的国际组织,不包括( )
A.东南亚国家联盟 B.华沙条约组织 C.亚太经合组织 D世界贸易组织
1.下列事件表明美苏争霸中,美国处于战略优势地位的是( )
A、华沙条约组织建立 B、古巴导弹危机
C、中美联合公报发表 D、重点扶持汽车工业
19.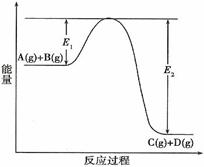 反应A(g)+B(g)
反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问
C(g) +D(g)过程中的能量变化如图所示,回答下列问
(1)该反应是____________________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),原因是________________________________________
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________.
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”)。
17.应用化学反应需要研究化学反应的应用。
 (1)已知反应:Br2+2Fe2+=2Br-+2Fe3+ ,向10mL、0.1mol·L-1的FeBr2溶液中通入0.001molCl2,反应后,溶液中除含有Cl-外,还一定 (填序号)。
(1)已知反应:Br2+2Fe2+=2Br-+2Fe3+ ,向10mL、0.1mol·L-1的FeBr2溶液中通入0.001molCl2,反应后,溶液中除含有Cl-外,还一定 (填序号)。
①含Fe3+,不含Fe2+②含Fe3+,不含Br-③含Fe3+,含有Br-
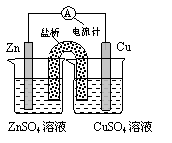
(2)右图为一原电池的结构示意图,下列说法中不正确的是
A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该反应一定为放热反应
 B.原电池工作时,Zn电极流出电子,发生氧化反应
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生还原反应,CuSO4溶液蓝色变深
D.如果将Cu电极改为Fe电极,Zn电极依然作负极、被腐蚀
(3)高铁酸盐在能源环保领域有广泛用途。我国学者提出铁作电极电解浓NaOH溶液制高铁酸盐Na2FeO4,装置如右图所示。
①Fe电极作 极(填阴、阳);
②Ni电极的电极反应式为: 。
(4)氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:
NO3- +4H++3e- = NO+2H2O
 ①KMnO4、Na2CO3、Cu2O、KI四种物质中的
(填化学式)能使上述还原过程发生。
①KMnO4、Na2CO3、Cu2O、KI四种物质中的
(填化学式)能使上述还原过程发生。
②欲用右图装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定 推(计)算反应速率。
 18.有10mLNaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3 的混合溶液。向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如下图所示。
18.有10mLNaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3 的混合溶液。向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如下图所示。
请回答下列问题:
(1)向Na2CO3和NaHCO3的混合溶液中滴加盐酸时发生反应的离子方程式为:
、 。
(2)混合溶液中Na2CO3和NaHCO3的物质的量之比为 。
(3)原NaOH溶液中NaOH的物质的量浓度为 ,所通CO2气体的体积在标准状况下为 。
(4)a mL同浓度的NaOH溶液,与足量的CO2发生反应,得到的溶液中所含溶质的最大质量为 (用含a的数字表示示)
16.一定条件下,在一个体积为10L的固定容器中发生反应:
N2(g)+3H2(g)  2NH3(g)+Q(Q>0), 发应过程如下图:
2NH3(g)+Q(Q>0), 发应过程如下图:
(1)写出该反应的平衡常数表达式K=___________________________;K和反应物的平衡转化率都能表示可逆反应的进行程度。保持温度不变,增大H2的平衡转化率,则K值______(填编号)
 a.增大 b.减小
a.增大 b.减小
c.不变 d.无法确定
(2)据上图,反应0-2min的
v(N2)=________________mol/(L·min)。
(3)据图判断5min时,V正_______V逆(填大于、小于、或等于,下同);10-12min间,
V正_______V逆可能的原因_____________(填编号)
a.升高温度 b.增加H2
c.加入N2 d.移去NH3
(4)若在第10min时压缩容器体积,则平衡将_________移动(填“向左”、“向右”或“不”);达到平衡时c(H2)_______0.03mol/L(填“大于”、“小于”或”等于“)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com