
18.X、Y、Z、W四种元素的质子数之和是35,X、Y是相邻周期的同主族元素,Z、W 是相同周期的非金属元素,化合物ZW的相对分子质量是30,化合物YX的式量是40,则下列说法不正确的是
是相同周期的非金属元素,化合物ZW的相对分子质量是30,化合物YX的式量是40,则下列说法不正确的是
A.X的最简单氢化物的稳定性比Y的强
B.X的最高价氧化物的水化物的酸性比Z的强
C.ZW是一种气体,不用排空气法收集,原因是ZW在空气中易被氧化
D.YX构成的物质是一种硬度很高的新型材料
17.如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
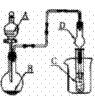 A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生
白色沉淀后沉淀又溶解
D.实验仪器D对防止溶液倒吸无作用
16.某化学科研小组研究在其他条件不变时,改变其一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):
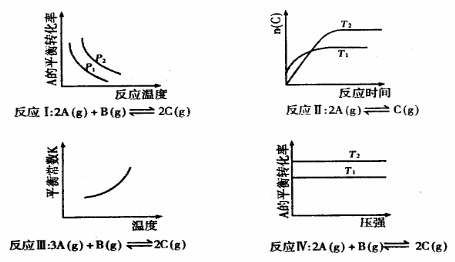
根据以上规律判断,下列结论正确的是 ( )
A.反应Ⅰ:△H>0,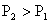 B.反应Ⅱ:△H>0,
B.反应Ⅱ:△H>0,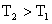 [
[
C.反应Ⅲ:△H>0
D.反应Ⅳ:△H<0,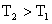
15.在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质 ①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3, 铜粉溶解的是
A.只有①或② B. 只有②或④
C.只有①或②或③ D. 上述四种物质中任意一种
14.如下图所示,利用海洋可提取很多重要的化工原料。
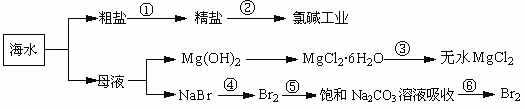 下列有关说法
下列有关说法 正确的是
正确的是
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸。
B.第②步中工业上可采用石墨为阴极,铁为阳极,采用阳离子交换膜的电解装置
C.第③步中结晶出的MgCl2·6H2O可在空气中受热分解 制无水MgCl2。
制无水MgCl2。
D.在第④步中溴元素被氧化,第⑤⑥步中既有溴元素被氧化也有溴元素被还原。
13.下列离子或化学方程式与所述事实相符且正确的是
A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
 B.用K37ClO3 与浓盐酸反应制氯气: K37ClO3 + 6HCl (浓) K37Cl
+ 3Cl2↑+ 3H2O
B.用K37ClO3 与浓盐酸反应制氯气: K37ClO3 + 6HCl (浓) K37Cl
+ 3Cl2↑+ 3H2O
C.向硅酸钠溶液中通入少量的CO2: SiO32- + 2CO2 + 2H2O =H2SiO3↓+ 2HCO3-
D.向AlCl3溶液中滴加过量的氨水:Al3++4OH-=AlO2-+ 2H2O
12. 向含有1mol的FeCl2溶液中通入0.2molCl2,再加入含0.1molX2O72-的酸性溶液,使溶液中Fe2+全部恰好氧化,并使X2O72-还原为 Xn+,则n值为(
Xn+,则n值为( )
)
A、2 B、3 C、4 D、5
11.钛被誉为“未来钢铁”、“太空金属”,原因是它的强度大,密度小,抗腐性能好,室温下,它不与水、稀盐酸、稀H2SO4、稀HNO3作用,但易溶于氢氟酸,推测其原因是( )
A.氢氟酸的酸性比其它酸强 B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强 D.钛离子易与氟离子形成可溶性难电离物质
10. 有四瓶溶液:已知它们分别是NaCl、Na2SO4 、Na2CO3、NaHCO3 ;现只有四种试剂:①AgNO3;②BaCl2;③H2SO4;④盐酸。欲分别检验出四瓶无色溶液,正确选择试剂的顺序是( )
A.①④ B.①③ C.②④ D.③④
9.某无色混合气体可能含有Cl2、O2、HCl、NH3、NO、NO2中的两种或多种,现将此混合气体经过浓硫酸后体积减小,将剩余气体排入空气中,很快变成红棕色。对于原混合气体成分的判断中,正确的是( )
A.肯定有O2 B.肯定没有Cl2、NH3、NO2
C.肯定有NH3、NO、HCl D.肯定只有NH3和NO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com