
3.藏文史籍《萨加世系史》载:“元帝辖十一省,西藏之地面虽不足一省,但因为它是八思巴的住地和教法所在,故作为一省委付与八思巴。”管理这一省的中央机构是( )
A.中书省 B.西藏行省 C.巡检司 D.宣政院
2.明史专家吴晗在《朱元璋》一书中曾这样描述我国古代的君臣关系:“在宋以前有三公坐而论道的说法……到宋朝便不然了。从太祖以后,大臣上朝在皇帝面前无坐处,一坐群站,……到了明代,不但不许坐,站着都不行,得跪着说话了”。君臣关系从坐而站而跪,说明中国古代中央政治制度演变的重要特点是( )
A.中央对地方的管理日益加强 B.内阁制度日渐成熟
C.丞相权力被六部分割 D.中央的权力日益向帝王集中
1.鼎是权力的象征,西周时期天子九鼎,诸侯七鼎。考古发掘表明,春秋时期诸侯墓葬中也有用九鼎的现象。这说明春秋时期( )
A.奴隶主越来越奢侈腐化 B.冶铸业制鼎规模的扩大
C.天子与诸侯等级关系发生了重大变化 D.春秋时期社会制度发生了根本变化
31、(5分)8.70g MnO2与100mL 37.0%密度为1.19g/cm3的浓盐酸共热(假设HCI没有损失),反应结束后,将剩余的溶液加水稀释至100mL。取出10mL溶液加入足量AgNO3溶液,有白色沉淀生成。求
(1)反应中生成的Cl2在标准状况下的体积.
(2)10.0mL溶液加入AgNO3溶液后生成沉淀的质量.
嘉兴市第一中学2009-2010学年第一学期期中考试
30、(6分)标准状况下,将44.8L HCl气体完全溶于1L水(密度为1.00g/cm3)中,得到密度为1.05g/cm3的溶液,
(1)求所得盐酸的质量分数为多少?
(2)求所得溶液的物质的量浓度?(计算结果保留到小数点后2位)
(3)将溶液取出250mL与足量的Zn反应可以产生多少体积的H2(在标准状况下) ?
29、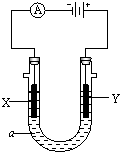 (13分)电解原理在化学工业中有广泛应用,右图为工业制氯气的装置原理。U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液。请回答以下问题:
(13分)电解原理在化学工业中有广泛应用,右图为工业制氯气的装置原理。U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液。请回答以下问题:
(1)a是 溶液。
(2)电解时在X极附近观察到的现象 。
Y电极上的产物是 ,检验该电极反应产物的方法是 ,检验涉及的化学方程式为: 。
(3)工业制氯气的化学方程式:
你认为这种制碱的方法存在的缺点是________(填序号)
A、消耗大量的电能 B、产品中氢气和氯气用途不大,造成浪费
C、食盐不易获取 D、生产过程中若处理不当易造成环境污染
(4)若收集的H2为2L,则同样条件下收集的Cl2 (填“>”、“=”或“<”)2L,原因是 。
28、(8分)用质量分数为37.5%的浓盐酸(密度为1.16 g / cm3)配制成1 mol / L的稀盐酸。现实验室仅需要这种盐酸220 mL。试回答下列问题:
(1) 配制稀盐酸时,应选用容量为 mL的容量瓶;
(2) 经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 。
A. 5 mL B. 10 mL C. 25 mL D. 50 mL
(3) 在量取浓盐酸后,进行了下列操作:
① 等稀释的盐酸其温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形标线1-2 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③ 在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号) 。
(4) 在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是
(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是 (填“偏高”、“偏低”、“无影响”)。
27、(10分)(1)除去KNO3固体中混有的少量NaCl,所进行的实验操作依次为:_________、加热蒸发、冷却、结晶、_________。
(2)证明某白色固体的成分是(NH4)2SO4的实验方法和结论是
第一步:取少量固体配成溶液
第二步:
第三步:
(3)常温下,某学生从一种强酸性的未知无色溶液中检出了Ag+,他还想通过实验检验溶液中是否还含有大量的Cl-、CO32-、NO3-、Cu2+、Fe3+、K+等。你认为其中 离子是需要检验的。检验你认为需检验的阳离子的方法是 .
26、(8分)在 K2Cr2O7 + 14HCl === 2KCl + 2CrCl3 + 3Cl2›+ 7H2O反应中。
=== 2KCl + 2CrCl3 + 3Cl2›+ 7H2O反应中。
(1) 元素被氧化, 是氧化剂。
(2) 是氧化产物, 发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸性作用的HCl的质量比为 。
(4)用双线桥标明电子转移的方向和数目。
25、下列变化中,必须加入氧化剂才能发生的是( )
A、SO2→S B、SO32-→SO2 C、I-→I2 D、HCO3-→CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com