
3.下列说法中正确的是( )
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅦA族元素从上到下得电子能力逐渐减弱
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第3周期元素的离子半径从左到右逐渐减小
2.下列叙述中,能肯定金属A比金属B活泼性强的是( )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子的电子层数比B原子的电子层数多
C.1molA从酸中置换出的H2比1molB从酸中置换出的H2多
D.常温时,A能从水中置换出H2,而B不能
1.若Q、E是同周期的非金属元素,如果Q原子半径比E大,则下列叙述正确的是( )
A.Q的最高价氧化物对应水化物的酸性比E的最高价氧化物对应水化物的酸性强
B.Q的阴离子比E的阴离子还原性强
C.Q原子得电子的能力比E原子得电子的能力强
D.Q的气态氢化物比E的气态氢化物稳定
1.第ⅦA族结构、性质比较
|
元素符号 |
原子结构示意图 |
单质与H2化合的难易 |
最高价氧化物的水化物 |
得电子能力 |
|
|
化学式 |
酸性强弱 |
||||
|
F |
|
|
|
|
|
|
Cl |
|
|
|||
|
Br |
|
|
|||
|
I |
|
|
结论:ⅦA族元素最外层都有 个电子,在化学反应中都易 电子,他们原子得电子能力都 ,都是 的非金属元素。它们都能形成气态氢化物,最高价氧化物的水化物都是 ,能与大多数金属 ,其单质常做 剂。但是从氟到碘,原子电子层数 ,原子半径 ,失电子能力 ,得电子能力
注意:氧族、氮族等非金属主族元素性质的递变规律类似ⅦA族元素,但非金属性比同周期的ⅦA族元素 。
98.(09海南卷 10)门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
10)门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
 A.X单质不易与水反应
B.XO2可被碳或氢还原为X
A.X单质不易与水反应
B.XO2可被碳或氢还原为X
 C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
96.(09上海卷2)以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.:He
B.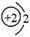 C.1s2
D.
C.1s2
D.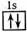
97(09海南卷2)同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是:
A.单质的化学活泼性:W<X<Y<Z B.原子最外层电子数:W<X<Y<Z
C.单质的氧化能力:W<X<Y<Z D.元素的最高化合价:W<X<Y<Z
95. (09四川卷10)X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物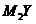 。下列说法正确的是
。下列说法正确的是
A. 还原性:X的氧化物>Y的氧化物>Z的氢化物
B. 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.
YX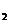 、M
、M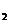 Y都是含有极性键的极性分子
Y都是含有极性键的极性分子
D. Z元素的最高价氧化物的水化物的化学式为HZO4
94.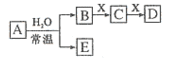 (09北京卷12)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如在右图转化关系(部分生成物和反应条件略去)
(09北京卷12)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如在右图转化关系(部分生成物和反应条件略去)
下列推断不正确的是
 A.若X是
A.若X是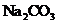 ,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是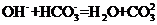 ,则E一定能还原
,则E一定能还原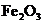
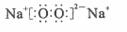 C.若D为CO,C能和E反应,则A一定为
C.若D为CO,C能和E反应,则A一定为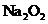 ,其电子式是
,其电子式是
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com