
5.从15世纪中期到18世纪末,殖民主义的特点主要表现为( )
①武力征服是其主要扩张手段 ②商品经济发展和资本主义产生是其主要动力 ③采用商业殖民方式,建立殖民贸易公司 ④掠夺财富、屠杀土著人、抢占土地是其主要活动
A.①②③ B.①② C.②③④ D.①②③④
4.新航路路开辟后引起的“商业革命”和“价格革命”都( )
A.促使西、葡两国由盛转衰 B.推动欧洲资本主义的迅速发展
C.加强世界各地间经济文化交流 C.引起金银贬值和物价上涨
3.新航路的开辟促进了世界市场雏形的形成。以下历史事件和现象,不属于新航路开辟的影响的是( )
A、明朝时期中国人的食谱发生了变化
B、欧洲市场上出现了烟草、可可等新的产品
C、欧洲商路和贸易中心由地中海转移到大西洋沿岸
D、欧洲产生资本主义萌芽
2.世界市场雏形出现的原因是( )
A.新航路的开辟 B.早期殖民扩张 C.造船技术的进步 D.资本主义工商业的发展
1.“直到1500年以前,大西洋一直是一道栅栏,一个终点。到1500年左右,它一变而为一座桥梁,一个起程点了。”从这一变化中受益的国家不包括( )
A.西班牙 B.葡萄牙 C.意大利 D.英国
13.(09年山东理综·31)(8分)(化学-化学与技术)
金属铝的生产是以Al2O,为原料,在熔融状态下进行电解:2Al2O3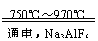
 4Al+3O2↑
4Al+3O2↑
请回答下列问题:
(1)冰晶石(Na3AIF6)的作用是 。
(2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”)。
(3)阴极和阳极均由 材料做成;电解时不断消耗的电极是 (填“阳极”或“阴极”)。
 (4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成 (填代号)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成 (填代号)。
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
答案:(1)降低Al2O3的熔化温度 (2)下层(3)碳素(或石墨) 阳极(4)c
 解析:Al2O3的熔点很高,熔化得需要较多能量,加入助熔剂就可节约能量,降低熔化温度
解析:Al2O3的熔点很高,熔化得需要较多能量,加入助熔剂就可节约能量,降低熔化温度
 (2)由于冰晶石(Na3AlF6)与氧化铝熔融物密度比铝的小,所以铝在熔融液的下层。
(2)由于冰晶石(Na3AlF6)与氧化铝熔融物密度比铝的小,所以铝在熔融液的下层。
 (3)电解时阳极的碳棒被生成的氧气氧化。
(3)电解时阳极的碳棒被生成的氧气氧化。
 (4)电解产生的铝要尽量以单质形式存在,所以将回收铝做成铝锭最好。
(4)电解产生的铝要尽量以单质形式存在,所以将回收铝做成铝锭最好。
12.(09年山东理综·29)(12分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
答案:(1)Zn(或锌) 正极
(2)Zn与Cu2+反应生成Cu,Zn与Cu构成原电池,加快反应速率 b
(3)2H++2e-=H2↑ 87g
 解析:(1) 负极上是失电子的一极 Zn失电子有负极经外电路流向正极。(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀。除杂的基本要求是不能引入新杂质,所以应选Zn将Cu2+
置换为单质而除去。(3)阴极上得电子,发生还原反应, H+得电子生成氢气。因为MnSO4-MnO2-2 e-,通过2mol电子产生1molMnO2,质量为87g。
解析:(1) 负极上是失电子的一极 Zn失电子有负极经外电路流向正极。(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀。除杂的基本要求是不能引入新杂质,所以应选Zn将Cu2+
置换为单质而除去。(3)阴极上得电子,发生还原反应, H+得电子生成氢气。因为MnSO4-MnO2-2 e-,通过2mol电子产生1molMnO2,质量为87g。
 [考点分析] 原电池原理和电解原理综合运用
[考点分析] 原电池原理和电解原理综合运用
11.(09年宁夏理综·37)[化学-选修化学与技术](15分)
请回答氯碱的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是 (填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
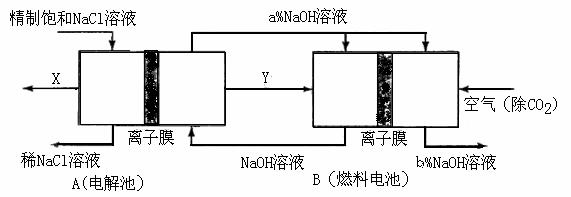 ①图中X、Y分别是
、
(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
①图中X、Y分别是
、
(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应正极: ; 负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
答案:(1)k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89(2)③①② (3)①Cl2 H2 a%小于b% ②O2+4e-+2H2O=4OH- H2-2e-+2OH-=2H2O ③燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗(其他合理答案也给分)
解析:(1)只要了解电解饱和食盐水的化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89;(2)只要抓住除钡离子要放在除碳酸根离子前即可得到顺序关系:③①②;(3)本题突破口在于B燃料电池这边,通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2 ;再转到左边依据电解饱和食盐水的化学方程式可知唯一未知的就是X,必然为Cl2了;A中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O=4OH- 可知NaOH+浓度增大。
2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89;(2)只要抓住除钡离子要放在除碳酸根离子前即可得到顺序关系:③①②;(3)本题突破口在于B燃料电池这边,通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2 ;再转到左边依据电解饱和食盐水的化学方程式可知唯一未知的就是X,必然为Cl2了;A中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O=4OH- 可知NaOH+浓度增大。
[点评]本题前半部基本就是课本内容的再现,但后半部很有创意,可以很好的综合考查考生的原电池和电解的相关知识
10.
 (09年江苏化学·16)(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
(09年江苏化学·16)(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:

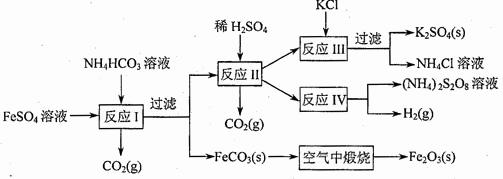
 (1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
(1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
 A.锌粉 B.铁屑 C.KI溶液 D.H2
A.锌粉 B.铁屑 C.KI溶液 D.H2
 (2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
(2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
 (4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
 答案:(1)B
答案:(1)B
 (2)防止NH4HCO3分解(或减少Fe2+的水解)
(2)防止NH4HCO3分解(或减少Fe2+的水解)
 (3)降低K2SO4
的溶解度,有利于K2SO4 析出。
(3)降低K2SO4
的溶解度,有利于K2SO4 析出。
 (4)2SO42-
-2e-
(4)2SO42-
-2e- 2S2O82-
2S2O82-
 解析:(1)在FeSO4溶液中除去溶液中的Fe3+,最好选用铁屑或铁粉,比较简单。(2)如果温度过高会导致NH4HCO3分解同样也会加快Fe2+的水解(温度越高水解速率越快)这样会使原料利用率降低。(3)由题目看出在III反应中生成的K2SO4 为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4的溶解度。
解析:(1)在FeSO4溶液中除去溶液中的Fe3+,最好选用铁屑或铁粉,比较简单。(2)如果温度过高会导致NH4HCO3分解同样也会加快Fe2+的水解(温度越高水解速率越快)这样会使原料利用率降低。(3)由题目看出在III反应中生成的K2SO4 为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4的溶解度。
 (4)根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,在根据反应后的产物得出正确的答案。
(4)根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,在根据反应后的产物得出正确的答案。
 [考点分析]此题为化工生产题型,主要考察了化合物性质,电极方程式书写。做此类题要分析清楚每一个环节目的和结果是什么。这样才能判断各反应后的产物分别是什么。
[考点分析]此题为化工生产题型,主要考察了化合物性质,电极方程式书写。做此类题要分析清楚每一个环节目的和结果是什么。这样才能判断各反应后的产物分别是什么。
9.(16分)(08年山东理综·30)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
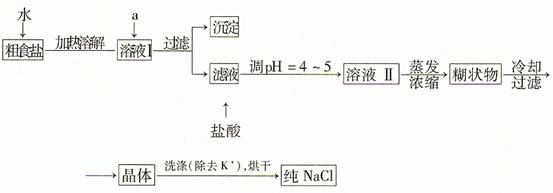
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的+Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次是 (只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 。
 (2)用提纯的NaCl配制500 mL
4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有
(填仪器名称)。
(2)用提纯的NaCl配制500 mL
4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有
(填仪器名称)。
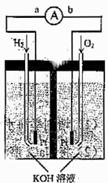
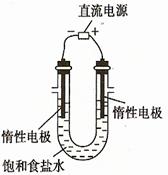
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2
(填“>”、“=”或“<”)2 L,原因是 。装置改进后可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为 。
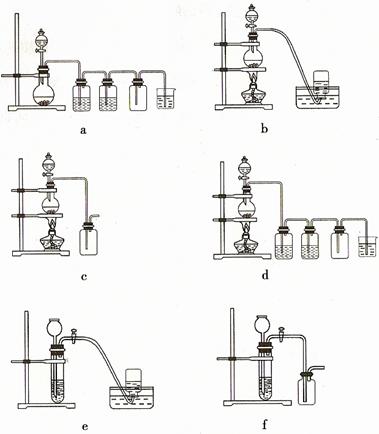
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4=ZnSO4+H2↑
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:
答案:
(1)①BaCl2、NaOH、Na2CO3(错选或多选本小题不得分。NaOH溶液的加入顺序及是否答Na0H不影响得分)
②75%乙醇
(2)天平、烧杯、500 mL容量瓶、胶头滴管
(3)< 电解生成的氯气与电解生成的NaOH发生了反应 酸碱中和滴定
(4)c d
解析:(1)①要除去SO42-,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子NO3-,再选用NaOH溶液除去Mg2+和Fe3+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的CO32-。Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+。②除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中。
(3)2NaCl+2H2O 2NaOH+Cl2↑+H2↑,在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同样条件下收集到的Cl2小于2L。
2NaOH+Cl2↑+H2↑,在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同样条件下收集到的Cl2小于2L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com