
2. 在HNO2溶液中存在如下平衡:HNO2 H++NO2-
,向该溶液中加入少量的下列物质
在HNO2溶液中存在如下平衡:HNO2 H++NO2-
,向该溶液中加入少量的下列物质
后,能使电离平衡向右移动的是 ( )
A.NaOH溶液 B.硫酸溶液 C.NaNO2溶液 D.NaHSO4溶液
1.某温度下,反应H2(g)+I2(g) 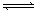 2HI(g);△H>0(正反应为吸热反应)。在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
2HI(g);△H>0(正反应为吸热反应)。在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温,压缩体积,平衡不移动,混合气体颜色加深
B.恒压,充入HI(g),开始时正反应速率减小,
C.恒容,升高温度,正反应速率减小
D.恒容,充入H2,I2(g)的体积分数降低
3、等物质的量的A B C D四种物质混合,发生如下反应:
aA(?)+bB(?)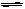 cC(s)+dD(?)
cC(s)+dD(?)
当反应进行到一定时间后,测的A减少nmol ,B减少n/2mol,C增加3n/2mol,D增加nmol,此时达到了平衡状态。
(1)该反应的各系数a -- b -- c-- d--
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则A--态,B--态,D--态。
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应是--反应。
答案:(1)2,1,3,2 (2)气,固态或液态,气 (3)放
巩固练习:
任何反应都伴随着能量的变化,通常表现为放热或吸热;所以温度对化学平衡移动也有影响。
大家观察试验2-7,得出结论:
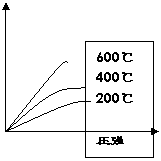 如果升高温度,平衡向_____的方向移动;降低温度平衡向_____的方向移动。
如果升高温度,平衡向_____的方向移动;降低温度平衡向_____的方向移动。
练习:
可逆反应2A+B 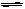 2C,
C%
2C,
C%
在不同压强及温度下达成平衡时,c的百分含量情况
如图所示。回答
(1)该反应的正反应是----热反应,
逆反应是气体体积----的反应。
(2)若c是气态,则A为--态,B为--态。
(3)若B为固态,则A为--态,c为--态。
答案:(1)吸,扩大,(2)气,气(3)气,固态或液态
浓度、压强、温度对化学平衡的影响可以概括为平衡移动的原理,也叫勒夏特列原理:____________________________________________________.
催化剂能够同等程度的改变正逆反应的速率,所以使用催化剂不能使平衡发生移动,但是可以改变达到平衡所需要的时间。
练习 1、能引起化学平衡移动的是( )
A、化学反应速率发生了变化。
B、有气态物质参加的反应达到平衡后,改变了压强。
C、由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的变化。
D、可逆反应达到平衡后,使用催化剂
2、在密闭容器中,反应2HI ==H2+I2(正反应吸热),当达到平衡时,欲使混合气体颜色加深,可采取的措施有( )
A减小容器体积 B降低温度
C加入催化剂 D恒容下充入HI气体
对于有气体参加的可逆反应来说,气体的压强改变,也能引起化学平衡的移动。
对于3H2(g)+N2(g) 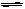 2NH3(g) 在反应中1体积的N2与3体积的H2反应生成2体积的NH3,即反应前后气态物质的总体积发生了变化,反应后气体总体积减少了。下表列入的是450℃时,N2与H2反应生成NH3的实验数据。
2NH3(g) 在反应中1体积的N2与3体积的H2反应生成2体积的NH3,即反应前后气态物质的总体积发生了变化,反应后气体总体积减少了。下表列入的是450℃时,N2与H2反应生成NH3的实验数据。
|
压强/MPa |
1 |
5 |
10 |
30 |
60 |
100 |
|
NH3/% |
2.0 |
9.2 |
16.4 |
35.5 |
53.6 |
69.4 |
由上表实验数据可以算出:对反应前后气体总体积发生变化的化学反应,在其他条件不变的情况下,增大压强,会使化学平衡向着__________移动。减小压强,会使化学平衡向着__________移动。
对于有些可逆反应里,反应前后气态物质的总体积没有发生变化,如2HI(g) 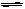 H2(g)+I2(g)在这种情况下,增大或减小压强都不能使化学平衡移动。
H2(g)+I2(g)在这种情况下,增大或减小压强都不能使化学平衡移动。
固态物质或液态物质的体积,受压强的影响很小,可以忽略不计。因此,如果平衡混合物都是固体或液体 ,可以认为改变压强不能使化学平衡移动。
练习 在一定的温度和压强下,合成氨反应 3H2+N2 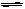 2NH3达到平衡时,下列操作平衡不发生移动的是(
)
2NH3达到平衡时,下列操作平衡不发生移动的是(
)
(A) 恒温恒压充入氨气
(B) 恒温恒压充入氮气
(C) 恒温恒容充入氦气
(D) 恒温恒压充入氦气
注意3:加入惰性气体后平衡体系是否发生移动,取决于平衡体系所占据的体积是否发生变化。若在恒容的条件下加入惰性气体,它并不能引起体系中其它物质的浓度改变,所以平衡不移动;若在恒压情况下加入惰性气体,必然引起平衡体系占据的体积增大,体系中其它物质的浓度发生变化,使平衡发生移动。
复习:
对平衡N2+3H2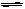 2NH3 ,如果在恒温恒容下加入氮气,平衡向--移动。
2NH3 ,如果在恒温恒容下加入氮气,平衡向--移动。
(2)如果在恒温恒容下加入氨气呢?加入氩气又怎么样呢?
(3)如果需要增加氢气的转化率,可以有什么办法?
(4)如果增大压强,正反应速率--,逆反应速率--,氮气的转化率--。
观察试验2-5:结论是,在其他条件不变的情况下,
增大反应物浓度,或减小生成物浓度。化学平衡向______移动。
减小反应物浓度,或增大生成物浓度。化学平衡向______移动。
注意:固体物质和纯液体无所谓浓度,其量改变,不影响平衡。
举例:已知氯水中存在如下平衡:
Cl2+H2O 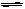 HCl+HClO。常温下,在一个体积为50ml的针筒内吸入40mL氯气后,再吸入10mL的水。写出针筒中可能观察到的现象。若将此针筒长时间放置,又可以看到何种变化?试用平衡的观点加以解释。
HCl+HClO。常温下,在一个体积为50ml的针筒内吸入40mL氯气后,再吸入10mL的水。写出针筒中可能观察到的现象。若将此针筒长时间放置,又可以看到何种变化?试用平衡的观点加以解释。
练习 FeCl2溶液呈浅绿色,其中存在着下列平衡:
Fe2++2H2O
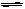 Fe(OH)2+2H+
Fe(OH)2+2H+
往该溶液中滴加盐酸,发生的变化是
(A) 平衡向逆反应方向移动
(B) 平衡向正反应方向移动
(C) 溶液由浅绿色变成黄色
(D) 溶液由浅绿色变为深绿色
思想:由FeCl2改为Fe(NO3)2,将发生什么变化呢?(答案:C)
3.在2升的密闭容器中2molSO2和一定量的氧气,发生反应,当反应进行到4min时,测得此时SO2为0.4mol,问在反应进行到2min时,密闭容器中SO2的物质的量是( )
A 1.6mol B 1.2mol C 大于1.6mol 小于1.2mol
[学习反馈或反思]:
若定义某反应物M在可逆反应中的转化率为:
M的转化率= 反应中已消耗的M的量×100%
 反应开始时加入M的量
反应开始时加入M的量
那么如果M的转化率不再随时间而改变,也证明可逆反应已达到平衡状态。
[跟踪练习]1.x、y、z都是气体,反应前x、y的物质的量之比是1:2,在一定条件下可逆反应x+2y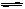 2z达到平衡时,测得反应物总的物质的量等于生成物总的物质的量,则平衡时x的转化率
2z达到平衡时,测得反应物总的物质的量等于生成物总的物质的量,则平衡时x的转化率
A.80% B.20%
C.40% D.60%
2.已知在450℃时,反应
H2(g)+I2(g) 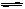 2HI(g)的K为50,由此推断出在450℃时,反应
2HI(g)的K为50,由此推断出在450℃时,反应
2HI(g)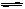 H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
A、50 B、0.02 C100 D无法确定
3.已知可逆反应2NO(g) ?N2(g)+02(g)。该反应的平衡常数表达式为 。若在某温度下达到平衡时c(N2)=0.05mol·L-1,C(O2)=0.05mol·L-1,c(NO)=0.00055mol·L-1 该反应的平衡常数为_____________。保持温度不变,将容器体积缩小一半,则平衡常数为_________;
2.对于一般的可逆反应mA+nB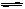 pC+qD,在一定温度下达平衡时反应物及生成物浓度满足下面关系:
pC+qD,在一定温度下达平衡时反应物及生成物浓度满足下面关系: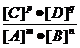 =K,式中K为常数,在密闭容器中给CO和水蒸气的混合物加热到800℃时,有下列平衡:CO+H20?C02+H2且K=1,若用2molCO和10molH20(气)相互混合并加热到800℃,达平衡时CO的转化率约为
=K,式中K为常数,在密闭容器中给CO和水蒸气的混合物加热到800℃时,有下列平衡:CO+H20?C02+H2且K=1,若用2molCO和10molH20(气)相互混合并加热到800℃,达平衡时CO的转化率约为
A.16.7% B.50%
C.66.7% D.83%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com