
3.“六合之内,皇帝之土;乃今皇帝,一家天下。”这则纪功刻石说的是 ( )
A.周天子分封天下 B.秦始皇统一六国
C.汉武帝开拓疆土 D.忽必烈一定乾元
2.帝王谥号主要依据其生前行为而定。下列各项中属于谥号的是 ( )
A.秦始皇 B.汉武帝
C.唐太宗 D.清康熙帝
1.西周实行宗法制的根本目的是 ( )
A.广建诸侯藩国 B.区分血缘亲疏
C.保证法律执行 D.巩固分封秩序
24.(12分)某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验采用以下步骤进行:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤ 过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量 。
A.比mg多 B.比mg少 C.恰好为mg
(2)溶解样品时要加入盐酸,原因是 。
(3)配制250mL溶液时,除需250mL的容量瓶、烧杯外,还需用到的玻璃仪器 是 。
(4)加入溴水时发生反应的离子方程式是 。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是 。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”)。
①NaCl ②Fe2(SO4)3
23.(8 分)下图每一方框中的字母代表一种反应物或生成物,它们都是中学化学中常见的物质。产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,L是水,D是淡黄色固体,E为单质。
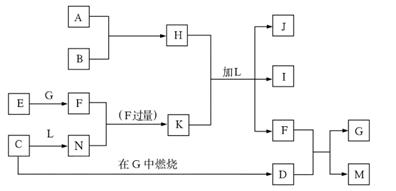
试填写下列空白:
(1)写出F的化学式: _______________。
(2)写出M发生水解的化学反应方程式__________________。 (3)反应C+G→D的化学方程式是_______________。 (4)写出H 、K加L生成J、I、F反应的离子方程式_______________。
21(10分)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,
已知:As是产物之一。
(1)写出并配平该反应的化学方程式 ;
(2)在该反应中,得电子的物质是 ,被氧化的元素是 ;
(3)在反应中,每转移1 mol电子,消耗(或生成)HCl mol;
(4)下列叙述正确的是 (填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.Sn和Pb位于同一主族,其+4价的化合物均很稳定
c.在相同条件下,还原性顺序:S2->I->Fe2+>Br->Cl-
22.(10分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验 ④ 后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
⑴用简要语言描述在实验 ① 中的操作
⑵根据上述实验判断原溶液中肯定存在的离子是______________,肯定不存在的离子是__________。
⑶写出与②③两个实验有关的离子方程式:
②___________________________ ③_________________________
20.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
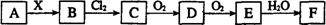
下列说法中不正确的是 ( )
A.当X是强酸时,A.B.C.D.E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A.B.C.D.E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
Ⅱ卷(非选择题 共40分)
19.将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+ 28HNO3=9Fe (NO3)x+ NO↑+14H2O 。下列判断合理的是 ( )
A.Fe (NO3)x中的x为2
B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移
C.稀HNO3 在反应中只作氧化剂
D.磁性氧化铁中的铁元素全部被氧化
18.图为短周期的一部分,推断关于Y、Z、M的说法正确的是 ( )
 A.非金属性:Y>Z>M
A.非金属性:Y>Z>M
B.原子半径:M>Z>Y
C.气态氢化物的稳定性:Y<M<Z
D.ZM2分子中各原子的最外层电子均满足8e-稳定结构
17.常温下,下列各组离子在给定条件下一定能大量共存的是 ( )
A.在pH=0的溶液中:I-、Ca2+、NO3-、NH4+
B.存在大量Fe2+的溶液:SCN-、Na+、NO3-、SO42-
C.在由水电离出的c(OH-)=10-13mol·L-1的溶液中:ClO-、Na+、SO32-、Cl-
D.在c(OH-)=1.0ⅹ10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com