
22.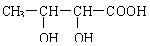 (7分)核磁共振氢谱(1HNMR)是研究有机物结构的有力手段之一。在所研究的化合物分子结构中的等性氢原子在1HNMR谱中会给出相应的峰(信号),峰的强度与H原子数成正比。例如:乙醛的1HNMR谱中有2个信号峰,其强度之比为3:l。
(7分)核磁共振氢谱(1HNMR)是研究有机物结构的有力手段之一。在所研究的化合物分子结构中的等性氢原子在1HNMR谱中会给出相应的峰(信号),峰的强度与H原子数成正比。例如:乙醛的1HNMR谱中有2个信号峰,其强度之比为3:l。
(1)请在右图所示分子的结构式中用“*”标记出手性碳原子。若用该有机物进行核磁共振实验,所得核磁共振氢谱有______个峰,强度比为_________。
(2)某硼烷已知其相对分子质量为28,核磁共振氢谱有两个峰且强度比为l:2,则该硼烷的分子式是______________,已知该硼烷气体在空气中能剧烈燃烧生成三氧化二硼和水,且生成l mol液态水可放出722kJ的热量,请写出燃烧的热化学方程式:
______________________________________________________________________
21.(9分)艾哈迈德·泽维尔因在飞秒化学反应动态学研究中突出贡献,而获得1999年诺贝尔化学奖。利用飞秒技术,人们可直接测量在化学反应中最短寿命的过渡态。人们发现在飞秒化学领域中,有一种无机物(白色钠盐)NaX。其有关实验是带有转折性的范例,为飞秒化学动态学建立了若干新概念。
 已知:①NaX溶于水呈中性。②在NaX的水溶液中滴加碱性盐NaY溶液时,溶液变成棕黄色。③若继续加过量NaY溶液,溶液又变成无色。④NaX溶液与FeCl3溶液作用,溶液变成棕色浑浊。⑤NaX溶液与AgNO3溶液作用,有黄色沉淀析出。⑥NaY与浓盐酸反应,有黄绿色刺激性气体生成。⑦此气体同冷NaOH溶液作用,可得到含NaY的溶液。
已知:①NaX溶于水呈中性。②在NaX的水溶液中滴加碱性盐NaY溶液时,溶液变成棕黄色。③若继续加过量NaY溶液,溶液又变成无色。④NaX溶液与FeCl3溶液作用,溶液变成棕色浑浊。⑤NaX溶液与AgNO3溶液作用,有黄色沉淀析出。⑥NaY与浓盐酸反应,有黄绿色刺激性气体生成。⑦此气体同冷NaOH溶液作用,可得到含NaY的溶液。
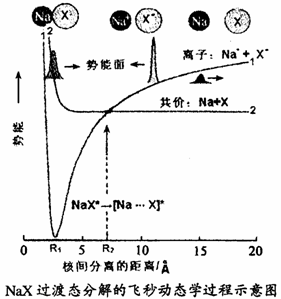
在NaX微粒的反应中(如右图所示)。用飞秒化学实验结果,人们首次证明有化学键的共振行为。在实时观测中发现,化学键的转化是沿反应坐标从共价键到离子键(曲线1、2,文献报道R1=2.70;R2=6.93)。从此实验,人们可以得到动态学的若干关键参数,如化学键断裂的时间、共价键/离子键的偶合量值,反应轨迹的分支等。问题:
(1)NaX*在核间距为多少时,有成钠原子分离? _________________________________________________________________
(2)NaX和NaY各是何种物质?
_________________________________________________________________
(3)写出下列反应的化学方程式:
②_____________________________________________
④_____________________________________________
⑥_____________________________________________
20.(11分)Tetraazidomethane是化学家2006年新制得的一种只由两种元素构成的化合物。这两种元素一种是有机物中必不可少的,而另一种则是大气中含量最高的元素。制备Tetraazidomethane的一种方法是由含锑盐A与一种钠盐B在一定条件下发生复分解反应。盐A的阳离子为三角锥形,含氮质量分数约为91.30%;阴离子为SbCl6-。钠盐B的阴离子和CO2是等电子体。Tetraazidomethane是一种高沸点的液体,含氮质量分数约为93.33%,有一定的危险性。
(1)与Tetmazidomethane含有相同元素的二元化合物可能有着截然不同的性质,比如按照化合价一般规律组成的最简单形式的化合物X在材料科学中有着特殊的研究意义。其化学式为_____________________。
(2)已知SbCl6-的中心原子上的价电子都用于形成共价键了,则SbCl6-的立体构型为____;B的阴离子的立体构型可能为____;
(3)B与KNO3混合,点燃后产生相当慢的爆炸,分两步进行反应,首先是B分解,产生金属和一种气体;该金属再与KNO3反应,释放出一种气体,同时得到两种用一般点燃法无法制备的金属氧化物。请写出可能发生反应的化学方程式:
①_____________________________________________________________________
②____________________________________________________________________
(4)硝化甘油是丙三醇与硝酸形成的酯,它分解能释放氮气、氧气、二氧化碳和水蒸气。请写出反应的化学方程式,并配平:_______________________________________________。Tetraazidomethane、硝化甘油与B均易发生爆炸反应的主要原因是:__________________
__________________________________________________________________。
19.(8分)2005年,苏丹红造成了全球性的食品安全事件,被称为自英国发生疯牛病以来最大的食品工业危机事件。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ 4种类型,国际癌症研究机构(IARC)将其归类为三级致癌物。由于苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危害人们健康。因此,加强苏丹红的监管对维护人们健康和社会稳定十分重要。苏丹红Ⅰ号的分子结构如图1所示。
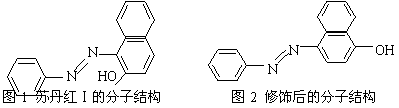
(1)苏丹红Ⅰ分子中的氮原子杂化类型是___________,其分子中所有原子是否有可能在同一平面________(填“是”或“否”),画出它的两个顺反异构体的结构简式:
_________________________________________________________________
(2)苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图2所示结构,则其溶解度会_________(填“增大”或“减小”),熔点_________(填“升高”或“降低”),原因是____________________________________________________________________。
18.(9分)向Cu(NH3)4SO4的水溶液通入SO2至溶液呈微酸性,生成白色沉淀Q(化学式NH4CuSO3)。将Q与足量的l0 mol/L硫酸混合微热,生成金属单质A、有刺激性气味的气体B和溶液C。
(1)写出生成Q的化学方程式:_________________________________________________
(2)Q晶体中呈正四面体的原子团是:__________,Q中_________(填“有”或“没有”)未成对电子;
(3)溶液C的颜色是_____色的;金属单质A是______色的,其重要用途之一是________;
(4)写出Q与足量10mol/L硫酸混合微热反应的化学方程式:
_____________________________________________________________________
17.(11分)目前实验室制乙烯通常用95%乙醇经浓硫酸脱水的传统方法,该方法由于浓硫酸的强脱水性和氧化性,使得反应有着严重的炭化和氧化现象;反应过程中产生SO2等难闻气体,副反应多,产率较低;硫酸不好回收利用。据最新文献报道,可用焦磷酸代替浓硫酸做催化剂制备乙烯,再与液溴反应合成l,2-二溴乙烷。反应比较稳定,易于控制,具有很好的经济和环保价值。合成步骤如下:
在装有温度计的干燥的三口烧瓶中,加入少许干沙,在室温下先向瓶中加入约10mL的无水乙醇和焦磷酸(由两分子磷酸在250~280℃脱去一分子水制得)配成的混合溶液,加热到180-190℃,从滴液漏斗中开始滴加剩余的混合溶液,使反应平稳进行,乙烯气体经碱洗、干燥,通入装有液溴的反应瓶中,反应结束后,粗产品蒸馏,收集129-133℃的组分即得到产物l,2-二溴乙烷。
(1)根据实验步骤,写出合成1,2-二溴乙烷的反应方程式:
___________________________________________________________________________
(2)写出由磷酸合成焦磷酸催化剂的反应方程式:__________________________________
(3)乙烯气体经碱洗、干燥,除去的主要杂质是_______________、______________。
(4)乙烯与溴反应时,应根据_____________________________现象,确定反应终点。
(5)如取57.6 g无水乙醇,50.5 g液溴,得到51.5 g产物。则l,2-二溴乙烷的产率为______。
16.(5分)将一铅片插入PbCl2溶液,铂片插入含有FeCl2和FeCl3的溶液,两溶液通过盐桥连接起来,铅片与铂片用导线连接,并在中间串联一个电流计。在外电路中电子由铅电极流向铂电极,铅电极是______极,其半电池反应为____________________________;铂电极是______极,其半电池反应为____________________________,总的电池反应为(用离子方程式表示)__________________________________________________________。
15.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。则下列分析推理中不正确的是
|
|
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0 mol/L
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2 g时盐酸过量 D.15.7 g混合物恰好与盐酸完全反应
14.美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50W的电力。一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-,下列对该燃料电池的说法不正确的是
A.在熔融电解质中,O2-由负极移向正极
B.该电池的总反应是:C3H8+5O2→3CO2+4H2O
C.电路中每流过5 mol电子,标准状况下约有5.6 L丙烷被完全氧化
D.通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-=3CO2+4H2O
13.右图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3K时开始分解为无水硫酸钠。现有142 g温度为T2K的饱和硫酸钠溶液,当温度降为T1K或升为T4K(T4>T3)时析出固体的质量相等,则温度为T4K时Na2SO4的溶解度为
A.等于42 g B.大于42 g
C.小于40 g D.等于40 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com