
8、某固体样品在托盘天平上称得为10.5g (1g以下只能使用游码),如错将样品和砝码在托盘上的位置颠倒,则天平平衡时读数为
A、9.5g B 、10.5g C 、11.5g D 、11.0g
7、硒是半导体材料,也是补硒保健品中的元素。工业上提取硒的方法之一是用H2SO4 和NaNO3处理含硒的工业废料,而得到亚硒酸(H2SeO3)和少量(H2 SeO4),并使之富集,再将它们与盐酸共热,H2 SeO4转化为H2SeO3 ,主要反应为:
2HCl + H2 SeO4 == H2SeO3 + H2O +Cl2↑
然后向溶液中通入二氧化硫使硒元素还原为单质硒而沉淀,据此正确的判断为
A、H2 SeO4的氧化性比Cl2 弱 B、二氧化硫的还原性比二氧化硒弱
C、H2 SeO4的氧化性比H2SeO3强 D、浓硒酸的氧化性比浓硫酸弱
6、将某种金属卤化物和浓硫酸在烧瓶里加热后,可得无色卤化氢气体,则该金属卤化物是
A、氟化物 B、氯化物 C、溴化物 D、碘化物
5、卤素互化物的化学性质跟卤素单质很相似。溴化碘(IBr)是卤素互化物的一种,这种化合物在常温常压下是深红色的固体,熔点为41℃,沸点为116℃。下列对IBr的叙述中,错误的是
A、溴化碘是一种氧化剂 B、固体溴化碘是一种原子晶体
C、它可与NaOH溶液反应 D、它可与水反应:IBr + H2O == HBr +HIO
4、对下列封闭系统的物质进行加热,在加热的过程中确实发生了化学变化,,但最终又没有生成的物质的是
A、碳酸氢铵 B、碘 C、氯化铵 D、硫酸铵
3、标准状态下的H2、Cl2 的混合气体a L,经光照完全反应后,所得气体恰好能使b mol NaOH完全转变成盐,则a、 b的关系不可能是
A、b == a/22.4 B、 b<a/22.4 C、 b >a / 22.4 D、b ≥ a/11.2
2、化合物X具有以下性质:①它跟浓硫酸反应,生成一种带红棕色的雾状混合物;②它在强热下也不分解;③它在水溶液中跟稀硫酸反应生成白色沉淀。X可能是
A、溴化钾 B、硝酸钡 C、溴化镁 D、溴化钡
1、硼晶体的基本结构单元是硼原子组成的正二十面体,其中,每个面均为正三角形,每个硼原子均与另外5个硼原子相连。由此推断在硼晶体的基本结构单元中的顶点数和棱边数分别是
A、60,12 B、12,30 C、30,12 D、10,30
29.HNO3是极其重要的化工原料。工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的。
(1)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失)。
① 试写出上述反应的化学方程式。
② 设循环操作的次数为n,试写出NO2→HNO3转化率与循环操作的次数n之间关系的数学表达式。
③ 计算一定量的二氧化氮气体要经过多少次循环操作,才能使95%的二氧化氮转变为硝酸?
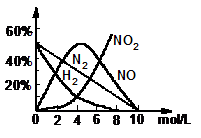 (2)上述方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围为:H2:C<6.6mol/L;N2和NH4+:C<10mol/L;NO:0.1mol/L<C<10mol/L;NO2:C>0.1mol/L。各气相产物成分及含量随HNO3浓度变化曲线如右图所示。
④ 写出Mg与11mol/L的HNO3反应的方程式;
(2)上述方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围为:H2:C<6.6mol/L;N2和NH4+:C<10mol/L;NO:0.1mol/L<C<10mol/L;NO2:C>0.1mol/L。各气相产物成分及含量随HNO3浓度变化曲线如右图所示。
④ 写出Mg与11mol/L的HNO3反应的方程式;
⑤ 960 mg Mg与1L 4mol/L的HNO3恰好完全反应,收集到224 mL气体(S.T.P)气体,试通过计算写出反应方程式。
28.人们在对烷烃分子空间结构的研究中发现某一系列的烷烃分子只有一种一卤取代物。如:

甲烷 (新)戊烷 十七烷
这一系列烷烃具有一定的规律性,当一种烃分子的-H全部被-CH3取代后,它的一卤代物异构体数目不变。试回答:
(1)请写出这一系列烷烃化学式的通式 ▲ 。
(2)请写出这一系列烷烃中第6种烷烃的化学式 ▲ 。
(3)上一系列烷烃中,其中含碳量最高的烷烃中碳元素质量分数约为 ▲ (保留三位有效数字)。
(4)人们在研究中发现另一系列烷烃分子也只有一种一卤取代物,请写出它们化学式的通式 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com