
11、(2)NaHCO3+HCl==NaCl+CO2↑+ H2O
(4)①应先将导管从烧杯中取出,再熄灭酒精灯
②碳酸氢钠受热会分解,碳酸钠受热不分解(或碳酸钠比碳酸氢钠稳定)
(5)碳酸氢钠的水溶液呈碱性,能使酸碱指示剂变色;它可与酸发生反应;它可与碱反应;它受热能分解。(任选三个性质)
(6)方案:取10g固体样品加热,可利用质量守恒定律,称量残留固体质量,得到质
量差(4.4g)即为气体二氧化碳的质量,可计算得到碳酸氢钠质量和质量分数。或取10g
固体样品加入盐酸50g(足量)充分反应,可利用质量守恒定律,称量反应后溶液质量,
得到差量(4.4g)即为气体二氧化碳质量,可计算得到碳酸氢钠质量和质量分数。或取
10g固体样品,加入7.3%的稀盐酸至恰好不再有气泡产生,共消耗了盐酸50g,将盐酸的
溶质质量代入计算,可计算得到碳酸氢钠质量和质量分数。
10、(1)加快溶解速度 (2)碳酸钠 CaCl2+Na2CO3==CaCO3↓+2NaCl
(3)烧杯 玻璃棒 漏斗 (4)盐酸 除去过量的Na2CO3
9、①CaCO3 CaO+CO2↑ ②CaO+H2O==Ca(OH)2
CaO+CO2↑ ②CaO+H2O==Ca(OH)2
③Ca(OH)2+K2CO3==CaCO3↓+2KOH
8、①存放在干燥、阴暗处 ②避免高温施用,常采用穴施或溶于水浇灌
1、D 2、A 3、D 4、B 5、D 6、A 7、C
11、某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质以后,联想到家庭中蒸制馒头
时常用的物质小苏打(NaHCO3),于是采用市售小苏打样品进行了如下的实验探究。
实验一: 探究碳酸氢钠的化学性质
(1)取样品溶于适量的水中,测得溶液的pH大于7。
(2)向小苏打固体中滴加盐酸,有大量气泡产生,该气体经检验是二氧化碳。
该反应的化学方程式为 。
 (3)取小苏打的溶液加入澄清石灰水,生成了白色沉淀。
(3)取小苏打的溶液加入澄清石灰水,生成了白色沉淀。
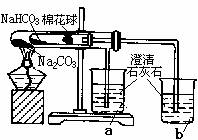
(4)同学们通过查阅资料,在老师的指导下采用了右图装置
对小苏打和纯碱做了对比实验。实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,
b烧杯中石灰水出现白色浑浊。
①在实验结束时,操作上要特别注意的问题是:
;
②由实验现象可以得出的结论是 。
(5)请你根据以上实验,归纳出小苏打的化学性质(至少三点):
。
实验二: 测定小苏打样品中NaHCO3的质量分数
市售的小苏打样品NaHCO3的质量分数的标注为95%,该兴趣小组对此产生了疑问,于是又进行了下面的实验。(假设小苏打样品中的杂质可溶解于水,对实验测定无影响)
方案1:取10 g固体样品加水完全溶解后,加入足量澄清石灰水,反应方程式如下:
Ca(OH)2 + NaHCO3= CaCO3↓+ NaOH + H2O ,过滤得到沉淀CaCO3, 干燥后称量质量为10 g。经计算得到NaHCO3质量为8.4g。
结论:小苏打样品中NaHCO3的质量分数仅为84 %,低于标注。
利用本题中给出的信息,请你设计出新的测定方案,简述实验方法和结论。
(6)方案2:
10、为除去NaCl固体中混有的少量CaCl2。根据如下操作,回答有关问题:
(1)将样品置于烧杯中,加入适量水溶解,同时用玻璃棒搅拌。搅拌的目的是 。
(2)向溶液中加入稍过量的 溶液,发生反应的化学方程式为:
。
(3)过滤。过滤操作中,必须用到的玻璃仪器有 。
(4)向滤液中加入适量的 ,其目的是 。然后进行蒸发,即可得到纯净的氯化钠。
9、我国古代纺织业常用氢氧化钾作漂洗的洗涤剂。前人将贝壳(主要成分是碳酸钙)灼烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用,即可制成氢氧化钾。请用化学方程式表示上述过程。
① ;② ;③
8、化学是有用的,学习化学可以帮助我们正确认识和使用物质。根据你对化肥碳酸氢铵的了解,写出在保存和施用时要注意的事项
① 保存时须注意 ;
② 施用时须注意 。
7、欲确保含有盐酸的氯化钙溶液变为中性而不引入新的杂质,在不用指示剂的条件下,应加入的试剂是( )
A.生石灰 B. 熟石灰 C. 石灰石粉末 D. 纯碱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com