
20、(20分)实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。 应量取盐酸体积________mL ,应选用容量瓶的规格________mL。 除容量瓶外还需要的其它仪器___________________________。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________________
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3) 操作A中,将洗涤液都移入容量瓶,其目的是_______________________________。
溶液注入容量瓶前需恢复到室温,这是因为__________________________________。
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作___________ ; b.加蒸馏水时不慎超过了刻度______________ ;
c.定容时俯视________________。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ?__________________
21(12分)(1)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e- → NO+2 H2O
在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
① 写出并配平该氧化还原反应的方程式, 用双线桥标出电子转移的方向和数目
②被还原的元素______,还原剂是 。
③反应生成0.3mol H2O,则转移电子的数目为 个。
(2)向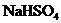 溶液中,逐滴加入
溶液中,逐滴加入 溶液至中性,写出发生反应的离子方程式:___________________________
_________.
溶液至中性,写出发生反应的离子方程式:___________________________
_________.
在以上中性溶液中,继续滴加 溶液,写出此步反应的离子方程式:
溶液,写出此步反应的离子方程式:
________________________________________.
22(4分)(1)向25mL 2mol·L-1稀硫酸中加入25mL 1mol·L-1的BaCl2溶液,充分反应后,溶液中H+物质的量浓度为(设稀溶液相混后总体积为原分体积之和) mol/L
(2)质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水.得到的溶液每毫升质量为q g,物质的量浓度为c.则溶质的相对分子质量为 。
班级 姓名 考号 考场
19.(10分)储氢纳米碳管的研制成功体现了科技的进步。用电孤法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应中的反应物和生成物有C、CO2、H2SO4 、K2Cr2O7 、K2SO4、Cr2(SO4)3 、H2O七种物质。
(1)请用上述物质填空,并配平化学方程式:
□C+□ H2SO4 →□ +□ +□Cr2(SO4)3 +□H2O
(2)上述反应中氧化剂是(填化学式) 。被氧化的元素是(填元素符号) 。 (3)H2SO4在上述反应中表现出来的性质是(填选项编号)___________。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为 。
18.用NA表示阿伏加德罗常数,下列说法正确的是( )
①18g D2O含有的电子数为10NA ②同温、同压下,相同体积的氧气和氩气所含的原子数相等
③标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA④在标准状况下,22.4LSO3的物质的量为1mol⑤100℃时6.72L的水所含的原子总数为0.9NA⑥0.1molOH-含0.1NA个电子⑦1mol Na2O2与水完全反应时转移电子数为2NA
A.③⑤⑥⑦ B.③⑤ C.①②④⑦ D.③④⑤⑥
第Ⅱ卷(非选择题 共46分)
17.将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
( )
A.NO2 B.N2O2 C.N2O D.N2O4
16.设NA为阿伏加德罗常数的值,下列叙述中,正确的是( )
A.常温下,11.2甲烷中含有的分子数为0.5NA
B.7gCnH2n中含氢原子数为NA
C.0.1mol·L-1氢氧化钠溶液中含钠离子数为0.1NA
D.5.6g铁与足量稀硫酸反应时失去电子数为0.3NA
15.向存的大量Na+、C1-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离子组是
A.K+、Br-、CO32- B.A13+、H+、MnO4-
C.NH4+、Fe3+、SO42- D.Ag+、Ca2+、NO3-
14.下列各组物质中,每种物质都能被氧化又能被还原的是 ( )
A. FeCl2、Cl2、CuSO4 B. Cl2、Al、H2
C. H2S、HCl、H2O2 D. F2、K、HCl
13. Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是
A.Na2O2在反应中只作氧化剂 B.Na2FeO4既是氧化产物又是还原产物
C.O2是氧化产物 D.2mol FeSO4发生反应时,共有10mol电子转移
12. ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4 2ClO2↑+2CO2↑+K2SO4+2H2O。下列说法正确的是
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.K2SO4中的钾来源于KClO3 所以是还原产物。
D.1 molKClO3参加反应有2mol电子转移
11.标准状况下,mg气体A与ng气体B所含分子数相同,下列说法不正确的是 ( )
A. A与B相对分子质量之比为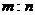
B. 同质量的A与B所含分子数之比为
C. 相同状况下,同体积的A与B的质量之比为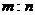
D. 标准状况下,A与B的密度之比为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com