
3.(08年宁夏理综·10)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(1)+4e-=4OH-
答案:C
解析:甲醇与氧气反应的化学方程式为:2CH3OH+3O2 2CO2+4H2O,化合价升高的元素为C,所以在负极上甲醇失去电子而放电,在该极上的电极反应式为:CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-。
2CO2+4H2O,化合价升高的元素为C,所以在负极上甲醇失去电子而放电,在该极上的电极反应式为:CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-。
2.(07年广东化学·20)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl--2e-=Cl2
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
答案:CD
解析:电解时阳极产生Cl2,电极反应为2Cl--2e-=Cl2,,故C对,阳极不可能是活泼性电极如铁,故A错。阳极产生Cl2与碱反应,故pH值降低,故B错,二价镍全部转化为三价镍失e-,故D对。
1.(07年广东化学·9)科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A.H2+2OH-=2H2O+2e-
B.O2+4H++4e-=2H2O
C.H2=2H++2e-
D.O2+2H2O+4e-=4OH-
答案:C
解析:难度:易,电解液为酸性,故A错,负极通入氢气,正极通入氧气,故B、D错。
 例1.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:
例1.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:
(1/2) H2+NiO(OH) Ni(OH)2
根据此反应式判断下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,H2是负极
解析:电池的充、放电互为相反的过程,放电时是原电池反应,充电时是电解池反应。根据氢镍电池放电时的总反应式可知,电解质溶液只能是强碱性溶液,不能是强酸性溶液,因为在强酸性溶液中NiO(OH)和Ni(OH)2都会溶解。这样可写出负极反应式:H2+2OH--2e- == 2H2O,H2为负极,附近的pH应下降。放电时镍元素由+3价变为+2价,被还原,充电时氢元素由+1价变为0价,被还原。
故答案为C、D项。
例2.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得电子,电极反应式为 O2+2H2O+4e-=4OH-
④电池放电后,溶液PH不断升高
A.①② B.①③ C.①④ D.③④
解析:本题是考查原电池原理在燃料电池中的具体应用,首先要判断出电池的正负极,其方法是确定在该电极上发生的是失电子还是得电子反应,若发生的是失电子反应是原电池的负极,反之是正极。CH4在铂电极上发生类似于CH4在O2燃烧反应,即CH4 →CO2严格讲生成的CO2还与KOH反应生成K2CO3,化合价升高,失去电子,是电池的负极,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,1molCH4参加反应有8mole-发生转移,O2在正极上发生反应,获得电子,电极反应式为O2+2H2O+4e-=4OH-。虽然正极产生OH-,负极消耗OH-,但从总反应CH4+2O2+2KOH=K2CO3+3H2O可看出是消耗KOH,所以电池放电时溶液的PH值不断下降,故①②正确,③④错误。
答案:A
例3.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是 ( )
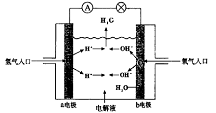
A.a电极是负极 B.b电极的电极反应为:4OH--4e-== 2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
解析:分析氢氧燃料电池原理示意图,可知a极为负极,其电极反应为:2H2-4e-==4H+,b极为正极,其电极反应为:O2+2H2O+4e-==4OH-,电池总反应式为:2H2+O2==2H2O。H2为还原剂,O2为氧化剂,H2、O2不需全部储藏在电池内。
故答案为B项。
例4.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+ 2MnO2(s) + H2O(l) == Zn(OH)2(s) + Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e- == Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
解析: 该电池的电解液为KOH溶液,结合总反应式可写出负极反应式:Zn(s)+2OH-(aq)-2e- == Zn(OH)2(s),用总反应式减去负极反应式,可得到正极反应式:2MnO2(s)+H2O(1)+2e- == Mn2O3(s)+2OH-(aq)。Zn为负极,失去电子,电子由负极通过外电路流向正极。1molZn失去2mol电子,外电路中每通过O.2mol电子,Zn的质量理论上减小6.5g。
故答案为C项。
电极反应式的书写书。
写电极反应式是高考经常考的知识点。如何书写电极反应式呢?一般来讲,书写原电池的电极反应式应注意如下四点: 1、找正负极,即要准确判断原电池的正负极。
如果电池的正负极判断失误,则电极反应式必然写错,这是正确书写电极反应式的前提。一般而言,较活泼的金属成为原电池的负极,但不是绝对的。如将铜片和铝片同时插入浓硝酸中组成原电池时,铜却是原电池的负极被氧化,因为铝在浓硝酸中表面产生了钝化。此时,其电极反应式为:负极:Cu-2e- ==Cu 2+正极:2NO3-+4H + +2e-==2NO2+2H2O , 又如将镁铝合金放入6mol/L的NaOH溶液中构成原电池时,尽管镁比铝活泼,但镁不和NaOH溶液反应,所以铝成为负极,其电极反应式为:负极:2Al+8OH --6e-==2AlO2- +4H2O正极:6H2O+6e- ==3H2+6OH-
2、看电解质溶液,即注意电解质的酸碱性。
在正、负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系。如氢-氧燃料电池有酸式和碱式两种,在酸溶液中负极反应式为:2H2-4e-==4H+正极反应式为:O2+4H+ +4e-==2H2O;如是在碱溶液中,则不可能有H+出现,在酸溶液中,也不可能出现OH-。又于CH4、CH3OH等燃料电池,在碱溶液中C元素以CO32-离子形式存在,而不是放出CO2。 3、注意总反应方程式,要注意总的反应方程式的书写。
从理论上讲,任何一个自发的氧化还原反应均可设计成原电池。而两个电极反应相加即得总的反应方程式。所以,对于一个陌生的原电池,只要知道总反应方程式和其中的一个电极反应式,即可迅速写出另一个电极反应式。 4、注意转移电子数,要转移电子转移数相等。
在同一个原电池中,负极失去的电子数必等于正极得到的电子数,所以在书写电极反应式时,要注意电荷守恒。这样可以避免由电极反应式写总反应方程式,或由总反应方程式改写成电极反应式所带来的失误,同时,也可避免在有关计算中产生误差。
3、燃料电池:
又称连续电池:一般以天然燃料或其它可燃物质如H2、CH4等作为负极反应物质,以O2作为正极反应物质而形成的。燃料电池体积小、质量轻、功率大,是正在研究的新型电池之一。
(1)氢氧燃料电池主要用于航天领域,是一种高效低污染的新型电池,一般用金属铂(是一种惰性电极,并具有催化活性)或活性炭作电极,用40%的KOH溶液作电解质溶液。其电极反应式为:负极:2H2+4OH--4e-=4H2O正极:O2+2H2O+4e-=4OH-总反应式为:2H2+O2=2H2O
(2)甲烷燃料电池用金属铂作电极,用KOH溶液作电解质溶液。其电极反应式为:负极:CH4+10OH--8e-==CO3 2- +7H2O正极:2O2+4H2O+8e-== 8OH-总反应式为:CH4+2O2+2KOH==K2CO3+3H2O
(3)甲醇燃料电池是最近摩托罗拉公司发明的一种由甲醇和氧气以及强碱作为电解质溶液的新型手机电池,电量是现有镍氢电池或锂电池的10倍。其电极反应式为:负极:2CH4O+16OH--12e-==2CO3 2- +12H2O正极:3O2+6H2O+12e-==12OH-总反应式为:2CH4O+3O2+4OH- ==2CO3 2- +6H2O
(4)固体氧化物燃料电池该电池是美国西屋公司研制开发的,它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。其电极反应式为:负极:2H2+2O2-4e- = 2H2O正极:O2+4e- = 2O2- 总反应式为:2H2+O2= 2H2O
(5)熔融盐燃料电池:
该电池用Li2CO3和的Na2CO3熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在6500C下工作的燃料电池。熔融盐燃料电池具有高的发电效率,因而受到重视。其电极反应式为:负极:2CO+2CO3 2- -4e-==4CO2正极:O2+ 2CO2+4e-==2CO3 2-总反应式为:2CO+O2 ==2CO 2
2、蓄电池:可以多次反复使用,放电后可以充电复原,又称二次电池。
(1)铅蓄电池:铅蓄电池是一种常见的可充电池,在工农业生产和日常生活中有广泛的应用。该电池以Pb和PbO2作电极材料,H2SO4作电解质溶液。其电极反应式为:负极:Pb+SO4 2- -2e- = PbSO4 正极:PbO2+4H++SO42- +2e- =PbSO4+2H2O总反应式为:Pb+PbO2+2H2SO4==2PbSO4+2H2O
(2)碱性镍-镉电池:该电池以Cd和NiO(OH)作电极材料,NaOH作电解质溶液。其电极反应式为:负极:Cd+2OH--2e- == Cd(OH)2正极:2NiO(OH)+2H2O+2e- == 2Ni(OH)2+2OH-总反应式为:Cd+2NiO(OH)+2H2O==Cd(OH)2+2Ni(OH)2从上述两种蓄电池的总反应式可看出,铅蓄电池在放电时除消耗电极材料外,同时还消耗电解质硫酸,使溶液中的自由移动的离子浓度减小,内阻增大,导电能力降低。而镍-镉电池在放电时只消耗水,电解质溶液中自由移动的离子浓度不会有明显变化,内阻几乎不变,导电能力几乎没有变化。
(3)氢镍可充电池:该电池是近年来开发出来的一种新型可充电池,可连续充、放电500次,可以取代会产生镉污染的镍-镉电池。其电极反应式为:负极:H2+2OH--2e-==2H2O正极:2NiO(OH)+2H2O+2e-==2Ni(OH)2+2OH-总反应式为:H2+2NiO(OH)==2Ni(OH)2
知识点1:化学电池的概念
化学电池:借助于化学能直接转变为电能的装置。化学电池的主要部分是电解质溶液,和浸在溶液中的正极和负极,使用时将两极用导线接通,就有电流产生,因而获得电能。化学电池放电到一定程度,电能减弱,有的经充电复原又可使用,这样的电池叫蓄电池,如铅蓄电池、银锌电池等;有的不能充电复原,称为原电池,如干电池、燃料电池等。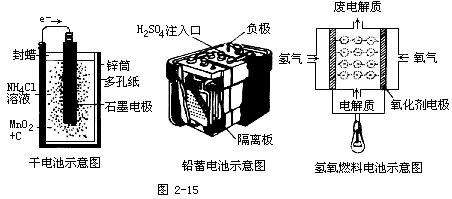
知识点2:化学电源品种繁多,大体可分为三类:
1、一次性电池:即电池中的反应物质在进行一次电化学反应放电之后就不能再次使用了。
(1)锌锰电池-干电池, 该电池的负极材料是锌,正极材料是碳棒,电解质是MnO2、NH4Cl、ZnCl2组成的糊状物。其电极反应式为:负极:Zn-2e- == Zn2+ 正极:2MnO2+2NH4+ +2e-==Mn2O3+2NH3+H2O总反应式为:Zn+2MnO2+2NH4+ == Zn2+ + Mn2O3+2NH3+H2O电池中MnO2的作用是将正极上NH4+还原生成的H氧化成为水,以免产生H2附在石墨表面而增加电池内阻。由于反应中锌筒不断消耗变薄,且有液态水生成,故电池用久后会变软。
(2)银锌电池-钮扣电池:
该电池使用寿命较长,广泛用于电子表和电子计算机。其电极分别为Ag2O和Zn,电解质为KOH溶液。其电极反应式为:负极:Zn+2OH- -2e- == ZnO+H2O正极:Ag2O+H2O+2e-==2Ag+2OH- 总反应式为:Zn+ Ag2O== ZnO+2Ag
(3)高能电池-锂电池:
该电池是20世纪70年代研制出的一种高能电池。由于锂的相对原子质量很小,所以比
容量(单位质量电极材料所能转换的电量)特别大,使用寿命长,适用于动物体内(如心脏起搏器)。因锂的化学性质很活泼,所以其电解质溶液应为非水溶剂。如作心脏起搏器的锂-碘电池的电极反应式为:负极:2Li-2e- ==2Li+ 正极:I2+2e-==2 I- 总反应式为:2Li+I2==2LiI
(4)海水铝电池:该电池是1991年我国首创以“铝-空气-海水”电池为能源的新型航海标志灯。这种灯以海水为电解质溶液,靠空气中氧气使铝不断氧化而产生电流,只要把灯放入海水中就能发出耀眼的闪光,其能量比干电池高20-50倍。其电极反应式为:负极:4Al-12e-==4Al 3+ 正极:3O2+4H2O+8e- ==8OH- 总反应式为:4Al+3O2+6H2O==4Al(OH)3
2. 燃料电池的工作原理的分析和电极方程式书写
本节难点: 电池的电极方程式书写
高考常考点:电池的电极方程式书写
本节重点:
1.了解化学电源的种类及其工作原理,知道它们在生产、生活和国防中的实际应用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com