
21.(1)使纯碱和H2SO4反应产生的CO2全部排出;NaOH溶液;吸收空气中的CO2;偏大
(2)洗气瓶(图略);浓硫酸吸水;偏大
(3)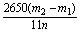 %
%
(4)防止空气中的水汽和CO2进入D被吸收
20、答案 (1)NaOH溶液和稀硫酸 (2)在隔绝空气的条件下,蒸发浓缩、冷却结晶 将滤渣F在空气中灼烧
(3)由滤液A制得氯化铝溶液不合理,所得氯化铝溶液中含有大量NaCl杂质

(2)6 : 15 : 30 : 5(2分)
19.CO32-、SO42-;Fe3+、Al3+、Cl-;K+;焰色反应。
1-5 dbbdd6-10 baadd 11-16ccdbac
21.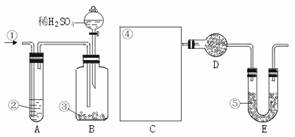 (18分)纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数。图中:①空气②某溶液③纯碱④某溶液⑤碱石灰
(18分)纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数。图中:①空气②某溶液③纯碱④某溶液⑤碱石灰
其实验步骤是:a.按右图所示,组装好实验仪器,并检查其气密性。b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g)。c.准确称量一定量的纯碱(设为n g),并将其放入广口瓶内。d.从分液漏斗中缓慢滴入一定量的稀硫酸,并从“①”处缓慢鼓入空气,直到B容器中不再产生气体为止。e.准确称量干燥管D的总质量(设为m2 g)。
根据上述实验回答下列问题:
(1)该实验进行到操作d时,要缓缓鼓入空气,其作用是____________________ 。装置A中盛装的液体“②”应选用________________,装置A的作用是________________,如果撤去装置A,直接向B中缓缓鼓入空气,则会导致实验测定结果(填“偏大”“偏小”或“不变”)________________。
(2)在空白格内画出装置C及试剂④是__________ ;装置C的作用是________________;如果撤去装置C,则会导致测定结果________________(填“偏大”、“偏小”或“不变”)
(3)根据此实验,计算纯碱中Na2CO3的质量分数的数学式为________________(用m1、m2、n表示)
(4)装置E的作用是________________________。
会昌中学2010-2011学年第一学期第一次月考试题答案及评分标准 高三化学
20.(8分)某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体。其实验方案如下:
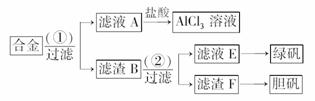
(1)所加试剂①、②分别是__________________。
(2)从滤液E中得到绿矾晶体的实验操作是
________________________________________________________________________;
从滤渣F制取胆矾的第一步操作最好采用
________________________________________________________________________。
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由________________________________________________________________________
________________________________________________________________________。
19.(8分)有一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后在滤液中滴入AgNO3溶液,有白色沉淀生成;
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
根据上述实验,这包粉末中一定不含有的离子是 ;肯定含有的离子是 ;不能确定是否含有的离子是 ,可通过 来进一步确定该离子。
18.(4分)酸性条件下,许多氧化剂可使KI溶液中的I-氧化,例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据题目要求填空:
(1)写出在醋酸存在的条件下KIO3溶液与KI溶液反应的离子方程式
;
(2)在酸性条件下(足量),各取1 L浓度为1 mol·L-1的KI溶液分别与上述列举四种溶液进行完全反应,则需要溶质的物质的量之比为n(KIO3):n(H2O2):n(FeCl3):n(K2Cr2O7)
= : : : .(要求写出最简比)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com