
1、暧昧:含糊、不明朗,不光明磊落,不便告人。爱语文网
暗昧:同“暧昧”。还可表示不聪明,愚昧。爱语文网
21、(本小题10分)铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):

请计算:
(1)实验所用的硝酸物质的量浓度为 mol/l;
(2)①中溶解了 g 铁;
(3)②中溶解的金属共 g ;
(4)每份金属混合物为 g ;
(5)④中V= mL。
20、(本小题16分)
A、某研究性学习小组在学习过氧化钠与二氧化碳的反应后,设计实验探究“过氧化钠与二氧化氮是否发生反应”。他们分析过氧化钠和二氧化氮的性质,从理论上分析,过氧化钠和二氧化氮都有氧化性。
①提出假设:
假设Ⅰ:若过氧化钠氧化二氧化氮(反应只生成一种盐),则发生反应:____________________________________;
假设Ⅱ:若二氧化氮氧化过氧化钠(反应生成一种盐和一种气体单质),则发生反应:______________________________。
②查阅资料:a.亚硝酸钠在酸性条件下能发生自身氧化还原反应:2NaNO2+2HCl===2NaCl+H2O+NO2↑+NO↑;
b.检验NO的原理:Cu+2NO+4H+Cu2++2NO2↑+2H2O。
③设计实验:a.在一瓶集气瓶里充满红棕色的二氧化氮,用药匙放进一勺淡黄色的过氧化钠粉末,盖上毛玻璃片用力振荡,用手摸瓶壁感觉发烫,红棕色迅速消失了;b.反应完后,用带火星的木条伸入瓶内,木条不复燃;c.向反应后的残余物中加入盐酸,无明显现象;d.将瓶内固体充分溶解,浓缩,再加入浓硫酸和铜粉共热,可产生红棕色有刺激性气味的气体,且溶液呈蓝色。
④实验结论:假设__________(填“Ⅰ”或“Ⅱ”)正确。
B、已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
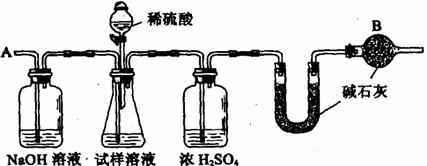
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)装置中干燥管B的作用是 ;
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果
(填高、偏低或不变);
(3)步骤⑤的目的是 ;
(4)步骤⑦的目的是 ;
(5)该试样中纯碱的质量分数的计算式为 。
19、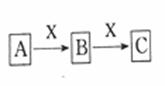 (本小题8分)具有如图转化关系的物质A、B、C有多种组合,请你根据下列要求回答问题。(如果有多组答案符合题意的,写出其中一种即可。)
(本小题8分)具有如图转化关系的物质A、B、C有多种组合,请你根据下列要求回答问题。(如果有多组答案符合题意的,写出其中一种即可。)
(1)若A是固态非金属单质,B是形成酸雨的物质,则C的分子式是 。
(2)若A是能使湿润红色石蕊试纸变蓝色的气体,符合要求的A→B的化学反应方程式为 。
(3)若A是强碱溶液,符合要求的B→C的离子反应方程式为
。
(4)若A是能使湿润淀粉碘化钾试纸变蓝色的气态非金属单质,符合要求的B→C的离子反应方程式为 。
18、(本小题8分)某无色溶液由Na+、Ag+、Ba2+、Al3+、AlO、MnO、CO、SO中的若干种组成。
取该溶液进行如下实验:
A、取试液适量,加入过量稀盐酸,有气体生成,得到溶液甲;
B、向溶液甲中再加入过量碳酸氢铵溶液,有气体生成,且析出白色沉淀乙,过滤得到溶液丙;
C、向溶液丙中加入过量氢氧化钡溶液并加热,有气体生成,且析出白色沉淀丁。 学
学
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是
。
(2)溶液中一定存在的离子是
。
(3)生成沉淀乙的离子反应方程式是
。
(4)写出步骤C中产生气体的离子方程式是
。
17、(10分)下图是元素周期表的一部分,请回答:


(1)形成元素化合物种类最多的元素是________(填元素名称);
(2)D、E、F的氢化物稳定性由强到弱的顺序是
______________________________(用相应的化学式填空);
(3)高温下,B置换出C的化学方程式:
_______________________________________;
(4)元素C的氧化物与A的最高价氧化物对应水化物反应的离子方程式:_________________________________________________;
(5)在元素周期表前10号元素中,两种元素原子的核外电子层数之比与最外层电子数之比相等的元素有_______对。
16、在粗碘中含ICl和IBr,受热时I2、ICl、IBr均可升华,在粗碘中加入一种物质后,再进行升华可制得精碘,应加入的物质是
A、H2O B、Zn C、KI D、KCl


 株洲四中 醴陵二中 醴陵四中
株洲四中 醴陵二中 醴陵四中
2009年下期期中考试三校联考高三年级化学科考试答卷
计分:

15、向含有amolAlCl3的溶液中加入bmol NaOH 溶液,观察到的现象是先有白色沉淀,后沉淀部分溶解,则生成Al(OH)3沉淀的物质的量是
A、a mol B、(4a-b)mol C、b mol D、(4b-a)mol
14、用NA表示阿伏加德罗常数的值。下列叙述正确的是

A、常温下,2.24LN2和O2的混合气体所含原子数为0.2NA

B、常温下,0.01mol/L的醋酸溶液中所含有的H+数小于0.01NA

C、标准状况下,生成1mol氧化钠和1mol过氧化钠转移的电子数分别为2NA和4NA

D、标准状况下,6.72L
CH4中所含的共用电子对数为1.2NA
13、下列反应的离子方程式中正确的是
A、钠与水的反应:Na + 2H2O = Na+
+ 2OH-+ H2↑
B、在NaHSO4溶液中加Ba(OH)2至中性:HSO+Ba2++OH-= BaSO4↓+H2O
C、过量的SO2通入NaOH溶液中:SO2+2OH-=SO+H2O
D、碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO+Ba2++OH-= BaCO3↓+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com