
19.(6分)已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
C3H8(g)+5O2(g) =3CO2(g)+4H2O(1) △H=-2220kJ/mol
根据上面两个热化学方程式,试回答下列问题:
(1)等质量的H2与C3H8完全燃烧,释放热量较多的是_________(填化学式)。
(2)现有H2和C3H8的混合气体共5mol,完全燃烧时放热3847kJ,则在混合气体中H2和C3H8的物质的量比是_________________。
18.常温时,相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是 ( )
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.两者产生等量的氢气 D.无法比较两者产生氢气的量
17.在一密闭容器中加入A、B两种气体,保持一定温度,在t1、t2、t3、t4时刻测得各物质的浓度如下:
|
测定时刻/s |
t1 |
t2 |
t3 |
t4 |
|
C(A)/mol·L-1 |
6 |
3 |
2 |
2 |
|
C(B)/mol·L-1 |
5 |
3.5 |
3 |
3 |
|
C(C)/mol·L-1 |
1 |
2.5 |
3 |
3 |
据此下列结论中正确的是 ( )
A.在容器中发生的反应为2A(g)+B(g)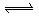 2C(g)
2C(g)
B.该温度下,此反应的平衡常数为0.25
C.A的转化率比B转化率的低
D.在t3时刻反应已经停止
16.汽车尾气净化中的一个反应如下:NO(g)+CO(g) N2(g)+CO2(g)
N2(g)+CO2(g)
△H=-373.4kJ·mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是 ( )
15.在已知25℃、101KPa条件下,反应:2N2O5(g)=4NO2(g) +O2(g) △H=+56.7kJ·mol-1 能自发进行的合理解释是 ( )
A.该反应是分解反应 B.该反应是熵减反应
C.该反应的熵变效应大于焓变效应 D.该反应的焓变效应大于熵变效应
14.可逆反应:A(s)+B(g) nC(g)
△H=Q在不同条件下反应混合物中C的百分含量和反应时间的关系曲线,如图所示。下列有关叙述中一定正确的是 ( )
nC(g)
△H=Q在不同条件下反应混合物中C的百分含量和反应时间的关系曲线,如图所示。下列有关叙述中一定正确的是 ( )
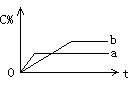
 A.若条件为催化剂,则a表示有催化剂,b表示没有催化剂
A.若条件为催化剂,则a表示有催化剂,b表示没有催化剂
B.若只控制温度,则a比b的温度高,Q>0
C.若只控制压强,则a比b的压强大,n≥2
D.由图象可以作出判断,反应从逆反应方向开始
13. 右图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合图中所示变化的反应是( )
右图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合图中所示变化的反应是( )
A.4NH3(g)+O2(g) 4NO(g)+6H2O(g)△H<0
4NO(g)+6H2O(g)△H<0
B.2SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
C.H2(g)+I2 (g) 2HI(g) △H >0
2HI(g) △H >0
D.C(s)+H2O(g) CO(g)+H2(g) △H >0
CO(g)+H2(g) △H >0
12.下列能确认化学平衡一定发生移动的是( )
A.化学反应速率发生改变
B.有气体参加的可逆反应达到平衡后,改变体系压强
C.由于某一条件的改变,使平衡混合物中各组分的物质的量浓度发生改变
D.没有气体参加的可逆反应达到平衡后,改变体系的温度
11.在恒容容器中,对于反应:2SO2(g)+O2(g) 2SO3(g),SO2和O2起始时分别为20mol和10mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
2SO3(g),SO2和O2起始时分别为20mol和10mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
A.10 mol和10% B.20 mol和20% C.20 mol和40% D.20 mol和80%
10.对反应:X(g) +3Y(g) 2Z (g),下列反应速率中最快的是 ( )
2Z (g),下列反应速率中最快的是 ( )
A.v(X)=0.3 mol·L-1·min-1 B.v(Y)=0.6 mol·L-1·min-1
C.v(Z)= 0.5mol·L-1·min-1 D.v(X)=0.01 mol·L-1·s-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com