
3、浓硫酸的三大特性
A、吸水性:将物质中含有的水分子夺去。
“水”可以是混合气体中的 ,也可以是结晶水合物中的 。
(可用作气体的干燥剂) 可干燥 气体
B、脱水性:将别的物质中的H、O按原子个数比2:1脱出生成水
可使有机物脱水碳化。如:C12H22O11(蔗糖)==12C+11H2O,
所以浓硫酸对有机物有强烈的腐蚀作用。
※如果皮肤上不慎沾上浓硫酸,正确的处理方法是 。
[对比]吸水性和脱水性的区别。
C、强氧化性:
a冷的浓硫酸使Fe、Al等金属表面 。
|
|
c与非金属反应: C+2H2SO4(浓)====
d 能与其他还原性物质反应 如H2S、HI等
讨论:
2、稀硫酸具有酸的通性,用方程式举例说明:
①
②
③
④
⑤
1、硫酸的物理性质:纯硫酸是 色 状的液体,沸点 ,密度 ,能与水以任意比互溶,溶解时 。
正常的雨水由于溶解CO2形成弱酸H2CO3,pH约为 。
空气中硫的氧化物和氮的氧化物随雨水降下就成为酸雨,酸雨的pH 。
硫酸型酸雨的形成途径:

SO3 H2SO4
SO2
|
反应方程式分别为
2.化学性质:
二氧化硫是一种酸性氧化物,它的水溶液呈 。
A、SO2是酸性氧化物: a.与水反应:
(H2SO3容易被氧化,生成硫酸 )
b.与碱反应:与NaOH溶液反应
与Ca(OH)2溶液反应
将SO2持续通入澄清石灰水中,现象如何?
B、SO2中S元素处于中间价态,既有氧化性又有还原性(以还原性为主)
a.弱氧化性:与硫化氢反应
b.较强还原性:可被多种氧化剂(如O2、Cl2、Br2、I2、HNO3、KMnO4、H2O2等)氧化
SO2与O2反应
SO2使氯水褪色:
SO2使溴水褪色:
C、SO2的漂白性:
SO2的漂白原理:SO2跟某些有色物质(如品红等)化合生成无色物质,但此无色物质 ,见光、遇热或长久放置又容易 ,又会恢复到原来的颜色(与HClO、过氧化氢等的漂白原理有本质区别)
SO2不能漂白酸碱指示剂,如SO2只能使紫色石蕊试液变红,不能使它褪色。
讨论并填表:
|
|
具 有 漂 白 性 的 物 质 |
||
|
物质 |
HClO、O3、H2O2 |
SO2 |
活性炭 |
|
原理 |
|
|
|
|
实质 |
|
|
|
|
效果 |
|
|
|
练习:1、下列物质均有漂白作用,其漂白原理相同的是 ( )
①双氧水 ②次氯酸 ③二氧化硫 ④活性炭 ⑤臭氧
A.①②⑤ B.①③⑤ C.②③④ D.①②③
1.物理性质:二氧化硫是一种 色有 气味的有毒气体,易液化;密度比空气 , 溶于水,常温、常压下1体积水大约能溶解 体积的二氧化硫。
8.生石灰中往往含有杂质CaCO3和SiO2,要检验是否存在这两种杂质,最好选用 ( )
A.水 B.盐酸 C.硫酸 D.烧碱
7.下列试剂不能贮存在磨口玻璃塞的试剂瓶里的 ( )
A.浓硫酸 B.NaOH溶液 C.盐酸 D.硫酸铜溶液
6.制备硅单质时,主要化学反应如下:(1)SiO2+2C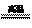 Si+2CO↑ (2)Si+2Cl2
Si+2CO↑ (2)Si+2Cl2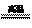 SiCl4 (3)SiCl4+2H2
SiCl4 (3)SiCl4+2H2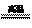 Si+4HCl
Si+4HCl
下列对上述三个反应的叙述中,不正确的是 ( )
A.(1)(3)为置换反应 B.(1)(2)(3)均为氧化还原反应
C.(2)为化合反应 D.三个反应的反应物中硅元素均被还原
5.下列物质的主要成分不是SiO2的是
A、水晶 B、石英 C、沙子 D、干冰
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com