
1.(07年广东化学·12)为了避免青铜器生成铜绿,以下方法正确的是
A.将青铜器放在银质托盘上
B.将青铜器保存在干燥的环境中
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层防渗的高分子膜
答案:BD
解析:铜绿是生活中常见现象,反应原理为2Cu+O2+CO2+H2O==Cu2CO3(OH)2,故青铜器应保存在干燥的环境中或表面覆盖一层防渗的高分子膜防止被腐蚀。A可能发生原电池反应而被腐蚀。
例1.下列叙述中正确的是[ ]
A.构成原电池正极和负极的材料必须是两种金属。
B.由镁、铝作电极与氢氧化钠溶液组成的原电池中镁是负极。
C.马口铁(镀锡铁)破损时与电解质溶液接触锡先被腐蚀。
D.铜锌原电池工作时,若有13克锌被溶解,电路中就有0.4mol电子通过。
解析: 两种活动性不同的金属与电解质溶液能够组成原电池,但不能因此说构成原电池电极的材料一定都是金属,例如锌和石墨电极也能跟电解质溶液组成原电池。
在原电池中,一般活动金属是负极。但还要考虑反应的实质。如氢氧化钠溶液中铝先溶解。
镀锡铁表皮破损后与电解质溶液组成原电池,铁较锡活泼,铁先失电子被腐蚀。
铜锌原电池工作时,锌负极失电子,电极反应为Zn –2e==Zn2+,1molZn失去2mol电子,0.2mol锌(质量为13克)被溶解电路中有0.4mol电子通过。故选D。
答案:D
例2.把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为 [ ]
A.A>B>C>D B.A>C>B>D
C.A>C>D>B D.B>D>C>A
解析:金属组成原电池,相对活泼金属失去电子作负极,相对不活泼金属作正极。负极被氧化质量减轻,正极上发生还原反应,有物质析出,由题意得活泼性A>B、A>C、C>D 、D>B,故正确答案为C。
答案:C
例3.某原电池反应的离子方程式为:Fe+2H+=Fe2++H2↑,则下列说法正确的是 [ ]
A.HNO3为电解质溶液 B.锌为原电池正极 C.铁极质量不变 D.铜为原电池正极
解析:由电池反应的离子方程式知,电池的负极为铁,则正极应是比铁不活泼的金属(B被否定).在反应中负极不断被消耗(C错).由于反应中放出了氢所并生成了Fe2+故知电解质溶液不能是HNO3.由上分析可知正确选项为D.
答案:D.
例4. 为研究金属腐蚀的条件和速率,某课外小组学 生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存一星期后,下列对实验结束时现象描 述不正确的是( )
述不正确的是( )
A.装置Ⅰ左侧的液面一定会上升
B.左侧液面装置Ⅰ比装置Ⅱ的低
C.装置Ⅱ中的铁钉腐蚀最严重
D.装置Ⅲ中的铁钉几乎没被腐蚀
解析:分析前2个装置中分别发生的反应类型为:吸氧腐蚀、析氢腐蚀第3个装置为不腐蚀。
所以Ⅰ中消耗氧气,左边的液面上升,Ⅱ中产生氢气,液面向下压,下降。Ⅲ中液面基本不变化。
答案:B D
例5.用酸性氢氧燃料电池电解苦卤水 (含Cl―.Br―.Na+.Mg2+)的装置如图所示 (a.b为石墨电极)。下列说法中,不正确的是( )
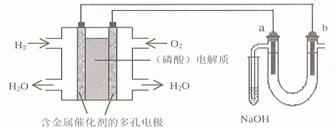
A.电池工作时,正极反应式为:O2 +2 H2O + 4e-=4 OH―
B.电解时,a 电极周围首先放电的是Br―而不是Cl―,说明当其它条件相同时前者的还原性强于后者
C.电解后期,电解的离子方程式为:2Cl― +2 H2O = Cl2↑+ 2 OH― +2H2↑
D.忽略能量损耗,当电池中消耗0.02g H2 时,b 极周围会产生0.02g H2
解析:电池工作时,正极反应式为:O2 +2 H2O + 4e-=4 OH― ,因为是酸性电池,电极产物应该为水,A错。电解后期,电解的离子方程式为:2Cl― +2 H2O = Cl2↑+ 2 OH― +2H2↑,因为溶液中有Mg2+离子,会产生Mg(OH)2的沉淀,应该为Mg2++2Cl― +2 H2O = Cl2↑+
Mg(OH)2↓+2H2↑,C错。当电池中消耗0.02g氢气失去0.02mol电子,得失电子守恒,
b 极周围会产生0.02g H2。
答案:A、C
3、电解质溶液中离子运动方向的判断
阳离子:向正极区移动 阴离子:向负极区移动
知识点2: 如何根据氧化还原反应原理来设计原电池呢?
请将氧化还原反应 Zn + Cu2+ = Cu + Zn2+设计成电池(要有盐桥装置):

此电池的优点:能产生持续、稳定的电流。
其中,用到了盐桥,什么是盐桥?作用是什么?
盐桥保障了电子通过外电路从锌到铜的不断转移,使锌的溶解和铜的析出过程得以继续进行。 导线的作用是传递电子,沟通外电路。而盐桥的作用则是沟通内电路。
知识点1: 原电池中的几个判断
1、原电池正负极的判断:
负极:电子流出的极或较活泼的金属电极或发生氧化反应的电极。
正极;电子流入的极或较不活泼的金属电极或发生还原反应的电极。
a、 根据活动性判断:
b、 负极(材料)发生氧化反应。 这种方法能判断简单原电池的正负极。如:Cu、Zn原电池,Zn比铜活泼,所以做负极,但是这种方法在针对一些特殊的原电池反应时就会发生误判。如:Cu、Al、浓HNO3组成的原电池时,就会发生误判(这里Cu做负极,Al做正极)。 b、根据本质来判断:失电子的一定是负极(电子从负极发出),化合价升高。 Zn + 2MnO2 + NH4+ =Zn2+ + Mn203 + NH3 + H2O Zn元素在反应中化合价升高(0→+2),所以Zn为负极。利用这种办法准确性较高。当然,这种方法需要知道大致的原电池反应方程式或者有图示提示(燃料电池一般是这样) c、从现象来判断:负极一般会溶解(质量减轻)。 这也是高考经常出现的原电池正负极判断方法之一。比如:在某一原电池反应中,原电池两极A、B,A极冒气泡,则A、B的活动性? A极冒气泡,故A为正极,故活动性:A<B 2、 原电池中电流方向与电子流向的判断
电流方向:正→负 电子流向:负→正
2.实例:负极:Zn-2e-=Zn2+ (氧化反应)
正极:2H++2e-=H2↑(还原反应)
一个自发的氧化还原反应通过一定的装置让氧化剂和还原剂不规则的电子转移变成电子的定向移动就形成了原电池。
知识点4: 一般用离子反应方程式表示原电池正负极的工作原理,又叫电极方程式或电极反应。一般先写负极,所以可表示为:
负极(Zn):Zn-2e=Zn2+ (氧化)
正极(Cu):2H++2e=H2↑(还原)
注意:电极方程式要①注明正负极和电极材料 ②满足所有守衡
总反应是:Zn+2H+=Zn2++H2↑
负极:电极本身失电子,发生氧化反应。
正极:电极本身不反应,溶液中的某些离子在正极上获得电子,发生还原反应。
阳离子放电顺(氧化性强弱顺序): Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
1.原电池的原理
负极----较活泼的金属--- 电子------发生 反应
正极----较不活泼的金属---- 电子----发生 反应
由电极本身性质决定:
正极:材料性质较不活泼的电极;
负极:材料性质较活泼的电极。
2.实例1:看锌、铜、稀硫酸哪个可以组成原电池? 以及反应情况。

知识点3: 原电池的原理
知识点1:原电池的概念
将化学能转变成电能的装置
知识点2:原电池的条件
1. 组成原电池的条件。①电极:两种不同的导体相连;
(如有两种活性不同的金属;一种是金属、一种是非金属导体;一种是金属、一种是金属氧化物等)。
②电极材料均插入电解质溶液中。(电解质溶液:能与电极反应)
③两电极相连形成闭合电路。
④自发发生的氧化还原反应
本节重点:①原电池的化学工作原理;
②原电池的形成条件及电极反应式;电子和电流的运动方向。
本节难点: 原电池的化学工作原理。
高考常考点:原电池的形成条件、电极反应式及电池反应方程式的书写。
22、(14´)设无穷等差数列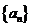 的前几项和为
的前几项和为 。
。
(1)若首项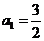 ,公差
,公差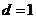 ,求满足是
,求满足是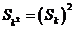 的正整数K
的正整数K
(2)求所有的无穷等差数列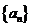 ,使对于一切正整数K,都有
,使对于一切正整数K,都有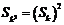 成立
成立
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com