
5、下列史实与第一次印巴战争相关的是 ①克什米尔王公同意加入印度 ②双方展开了激烈的空战和坦克大战 ③穆斯林进行“圣战” ④克什米尔归属问题得以解决 ( )
A ①③ B ②④ C ①②③ D ①②③④
4、巴以矛盾导致中东地区长期动荡,引起国际社会广泛关注。当前在联合国框架下解决巴以矛盾的基本原则是( )
A 以土地换和平 B 按宗教地区分治
C 大国协助解决 D 联合国托管耶路撒冷
3.斯塔夫里阿诺斯在《全球通史》中说:“在中国长达数千年的历史上,有过三次大革命,它们从根本上改变了中国的政治和社会结构。第一次发生于公元前221年……第二次发生于1911年……第三次在1949年”。第一次“革命”是指
A.中央集权制度建立 B.世袭制度确立
C.宗法式家族制度形成 D.世卿世禄制度确立
2. “先王之法,立天子不使诸侯疑焉,立诸侯不使大夫疑焉,立嫡子不使庶孽疑焉。疑生争,争生乱,是故诸侯失位则天下乱,大夫无等则朝堂乱。”但事与愿违,这种继承制度在政治上给西周带来的最不利的影响是
A.权力世袭制度渐渐地消亡 B.使世卿世禄的贵族特权自生自灭
C.贵族普遍地转化成为庶人 D.中央和地方的政治隶属关系失控
1.《左传•昭公七年》:“天有十日,人有十等。下所以事上,上所以共神也。故王臣公,公臣大夫,大夫臣士,士臣皂”。上述材料反映了西周社会结构的基本特点是( )
A.严格的等级关系 B.嫡长子拥有继承特权
C.通过垄断神权强化王权 D.血缘纽带和政治关系紧密结合
26.(7分)美国计划2015年再次登陆月球,继而在月球上建立基地,给人类登陆火星作准备。为了早日实现梦想,1992年美国进行了第一次利用实际的月球岩石――玄武岩(FeTiO3,钛酸亚铁)来制造氧气的试验。已知FeTiO3被H2还原后,生成Fe、TiO2和水,被C还原后生成Fe、TiO2和CO2。请参与探究,并回答下列问题:
Ⅰ.理论分析
(1)写出FeTiO3在加热时被H2还原的化学方程式: 。该反应中氧化剂为 ,氧化产物为 。
Ⅱ.实验探究
为了测定钛铁矿中可提取氧的质量分数,某研究性学习小组分别设计了以下两套实验装置:
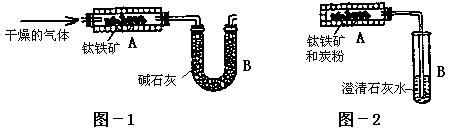
(2)学生甲设想用图-1装置(A为电加热装置)从钛铁矿中提取氧,请写出最简便的实验步骤:__________________________(选填下列数字编号)。
①通入N2;②停止通N2;③通入H2;④停止通H2;⑤加热;⑥停止加热;⑦称取装置B的质量。
(3)学生乙设想用图-2装置(A为电加热装置)从钛铁矿中提取氧,并且认为该方案的意义在于:反应产生的CO2可通过绿色植物的光合作用转化为营养物质,同时产生氧气:6CO2+6H2O
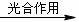 C6H12O6(葡萄糖)+6O2。实验过程中,称得反应前装置A中钛铁矿的质量为ag,炭粉的质量为bg,反应后装置B中产生CaCO3的质量为cg,则钛铁矿中可提取氧的质量分数的表达式为:_______________________。
C6H12O6(葡萄糖)+6O2。实验过程中,称得反应前装置A中钛铁矿的质量为ag,炭粉的质量为bg,反应后装置B中产生CaCO3的质量为cg,则钛铁矿中可提取氧的质量分数的表达式为:_______________________。
(4)经专家评审后,认定两个方案都很有意义,但实验设计方面还存在不足之处,例如图-2装置在加热时,生成的CO2不可能全部被澄清石灰水吸收,同时钛铁矿和炭粉在加热时还会产生CO,给实验带来误差。请提出对图-2所示装置应采取的改进措施:_______________________。改进后,实验自始至终需持续向图-2装置A中通入N2的目的是__________________________。
贵州省兴义市精华中学2010届高三第一次月考
25.(7分)某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、
Br-、I-。为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体。该气体能使饱和石灰水变浑浊。
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色。
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀。
(1)分析上述实验①,写出这一实验鉴定离子的结论与理由。
_______________________________________ 。
(2)由以上5个实验分析一定存在的离子是: 。
(3)上述5个实验不能确定是否的离子是___________________。
24.(13分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:__________________________________________________________________
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的总数是 ;反应中被还原的硝酸的物质的量是 ;消耗的Cu2O质量是 。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是______________________________________。
23.(8分)砷酸铅可用作杀虫剂。已知①在砷酸铅中,砷处于最高价态,铅处于稳定价态;②砷酸铅是正砷酸对应的盐,1 mol正砷酸分子中含有8 mol原子。请回答以下问题:
(1)砷的元素符号是_____________。
(2)砷的最高价氧化物的化学式为_______________;铅的最高价氧化物的化学式为________________。
(3)砷酸铅的化学式为___________________。
22、(6分)
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发生如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+
该反应常用于检验Mn2+的存在。其特征现象是_______________________,
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3+ MnSO4+ H2SO4- Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com