
18.铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是 ▲ ;
(2)铬元素以Cr2O72-离子的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+离子,再用沉淀法进行分离。
已知: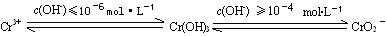
① FeSO4还原Cr2O72-的离子方程式为 ▲ 。
② Cr2 (SO4) 3溶液中加入过量NaOH浓溶液,反应的离子方程式为 ▲ 。
③ 沉淀法分离废水中的Cr3+离子,pH应控制在 ▲ 范围内。
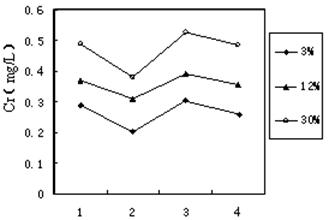 (3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:
(3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:
说明:1--用蒸馏水浸溶, 2--用稀硫酸浸溶,3--冻融后用蒸馏水浸溶,4--曝晒后用蒸馏水浸溶;3%等--制砖时含铬废渣掺入的比例。
已知我国规定 “固体废弃物浸出标准值含铬不得超过10 mg·L-1”。分析图表,可得出多个结论:
① 实验取用的砖样符合上述标准;
② 还能得出的其它结论是(写出2条即可) ▲ ; ▲ 。
17.(8分)如下图所示,在一定温度下,在一个容积为4L的密闭容器中,左室加入X molSO3,右室加入2 molSO2和1 molO2,中间是个可移动的隔板K,在少量催化剂存在下分别发生反应:

左室:2SO3(g)
 2SO2(g) + O2(g) 右室:2SO2(g)
+ O2(g)
2SO2(g) + O2(g) 右室:2SO2(g)
+ O2(g)  2SO3(g) △H=-197kJ/mol
2SO3(g) △H=-197kJ/mol
回答下列问题:
(1) 能说明反应达到平衡的是 ▲ ;
A、隔板不再移动 B、左右二室SO2和O2物质的量之比相等
C、左右两边SO2的物质的量相等 D、左右两边SO3的体积分数相等
(2) 当X=0.5时,平衡后右室SO2的体积分数为a;X=1时,平衡后右室SO2的体积分数为b,则a和b的关系是 ▲ ;
A、a>b B、a=b C、a<b D、无法确定
(3) 若平衡时隔板在中央,则X= ▲ , 左室吸收的热量为Q1 kJ,右室放出的热量为Q2 kJ,则Q1、Q2间满足的等式关系是 ▲ ;
16.(10分)已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。试回答下列:
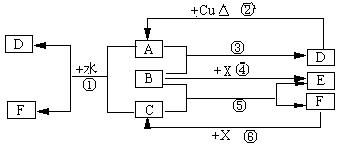
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是:(用化学式填写)
____________▲_____________________________________________。
(2)B的电子式为:_____▲__ __
(3)写出反应②的化学方程式: ▲ _______。
(4)写出反应①、⑥的离子方程式:
①_________________ ▲ ________;
⑥_______________ ▲ __________。
15.已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1-2 滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)仅限选用的仪器和试剂有:烧杯、试管、玻璃棒、量筒、滴管、药匙;酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳 、硫氰化钾溶液 、硝酸银溶液 、淀粉碘化钾溶液,完成以下实验探究过程:
[提出假设]
假设1:溶液呈黄色不是发生化学反应所致,是溶液中 ▲ 引起的(填微粒的化学式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中 ▲ 引起的。
[设计实验方案]
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
假设1方案: ▲ 。
假设2方案: ▲ 。
(2)根据高中所学的知识判断,你认为 ▲ (填“假设1”或“假设2”)的推断是正确的;若选用淀粉碘化钾溶液验证你的假设是否可行?_ ▲ (填“行”或“否”),理由是:________▲______________ 。
14.一定质量的Fe2O3、ZnO、CuO的固体混合粉末,在加热条件下用足量CO还原,得到金属混合物4.82g,将生成的CO2气体用足量的澄清石灰水吸收后,产生l0g白色沉淀。若用2mol·L-1的盐酸溶解该混合物,至少需要盐酸的体积为
A.50 mL B.100 mL C.200 mL D.缺少数据,无法计算
第Ⅱ卷(非选择题 共72分)
13.下列离子方程式的书写正确的是
A.实验室用浓盐酸与MnO2反应制Cl2:
MnO2
+4HCl(浓) Cl2↑+Mn2+ +2Cl-+2H2O
Cl2↑+Mn2+ +2Cl-+2H2O
B.将标准状况下1.12 L氯气通入10 mL 1 mol / L的溴化亚铁溶液中:
2Fe2++4Br-+3Cl2 =2Fe3++6Cl-+2Br2
C.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
Ca2++ HCO3- +OH- =CaCO3↓+H2O
D.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++ SO42- + NH4+ =BaSO4↓+ NH3·H2O +H2O
12. 根据下列实验现象,所得结论正确的是
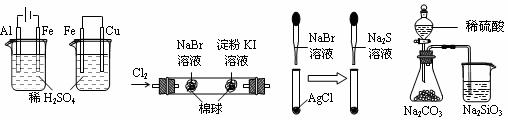
A. B. C. D.
|
实验 |
实验现象 |
结论 |
|
A. |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B. |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C. |
白色固体先变为淡黄色,后变为黑色(Ag2S) |
Ksp:AgCl>AgBr>Ag2S |
|
D. |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:S>C>Si |
11.新鲜水果、蔬菜、果汁中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,用淀粉溶液作指示剂,其化学方程式为:
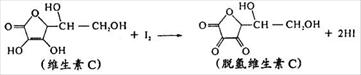
下列说法正确的是
A.上述反应为氧化反应 B.维生素C的分子式为C6H5O6
C.滴定时碘溶液盛放在碱式滴定管中 D.终点时溶液由蓝色恰好变无色
10.现有a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是
A.若a=b,pH(NaX) >pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-) + c(HY),则HX是强酸,HY是弱酸
C.若a>b,且上述两溶液呈碱性,c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY)
D.若两溶液等体积混合,测得c(X-) + c(Y-) + c(HX) + c(HY)=0.1mol/L,则可推出
a=b=0.1 mol/L
9.设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,密度为d g/L的某气体纯净物一个分子的质量为g
B.常温常压下,17g甲基(-14CH3)所含的中子数为9NA
C.25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子
D.4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com