
21.(1)基态N3-的电子排布式为 。
(2)N2中的 键比
键稳定(填“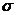 ”“
”“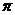 ”)。
”)。
(3)其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)。
(4)X的元素符号是 ,与同一个N3-相连的X+有 个。
(5)关于三聚氰胺分子的说法中正确的是 。
句容高级中学2010届高三12月调研测试
20.(1)m= ;
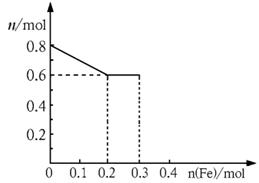 (2)该曲线表示的是_ _物质的量变化,请你在此图中再画出另外2种离子的物质的量的变化曲线并注明离子种类。
(2)该曲线表示的是_ _物质的量变化,请你在此图中再画出另外2种离子的物质的量的变化曲线并注明离子种类。
(3)
19.
①化学方程式:
②得电子的物质是 ,被氧化的元素是 。
③消耗HCl mol。
(2)①OA段所发生反应的离子方程式__________________ ____________________、
_________________ ____________________。
②当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
18.(1)原因是 ;
(2)
①离子方程式为 。
②离子方程式为 。
③pH应控制在 范围内。
(3) ;
。
17.(1) 能说明反应达到平衡的是 ;
(2) a和b的关系是 ;
(3) X= , Q1、Q2间满足的关系是 ;
16.(1)B、C、D、X氧化性从强到弱的顺序是:(用化学式填写)
___________________________________________________________。
(2)B的电子式为: __________。
(3)写出反应②的化学方程式: _______________________。
(4)离子方程式:
①_________________________________________________________________; ⑥_________________________________________________________________。
15.(1)假设1:溶液呈黄色不是发生化学反应所致,是溶液中 引起的(填微粒的化学式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中 引起的。
[设计实验方案]
假设1方案: 。
假设2方案: 。
(2)你认为 (填“假设1”或“假设2”)的推断是正确的;若选用淀粉碘化钾溶液验证你的假设是否可行?_ (填“行”或“否”),理由是:___________________ ___ 。
21.(物质结构与性质)氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 ▲ 。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的
▲ 键比 ▲ 键稳定(填“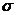 ”或“
”或“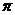 ”)。
”)。
(3)(CH3)3NH+和AlCl-4可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 ▲ (填“大”或“小”),可用作 ▲ (填代号)。
a、助燃剂 b、“绿色”溶剂
 c、复合材料 d、绝热材料
c、复合材料 d、绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成
的晶体结构如图所示。X的元素符号是 ▲ ,与同一个
N3-相连的X+有 ▲ 个。
(5)2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺 (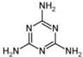 )。
)。
下列关于三聚氰胺分子的说法中正确的是 ▲ 。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高



 句容高级中学2010届高三12月调研测试
句容高级中学2010届高三12月调研测试
化学答卷纸
注意:将一、二项选择题答案填涂到答题卡上
20.取m g铁粉与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。
(1)若反应后的溶液中滴加KSCN溶液不变红色,则m= ▲ ;
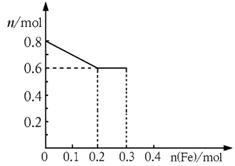 (2)若将铁粉慢慢加入到稀硝酸中,并搅拌,反应过程中溶液里Fe3+、Fe2+、NO3-三种离子中的某离子的物质的量的变化曲线如图所示,则该曲线表示的是_ ▲ _物质的量变化,请你在此图中再画出另外2种离子的物质的量的变化曲线并注明离子种类。
(2)若将铁粉慢慢加入到稀硝酸中,并搅拌,反应过程中溶液里Fe3+、Fe2+、NO3-三种离子中的某离子的物质的量的变化曲线如图所示,则该曲线表示的是_ ▲ _物质的量变化,请你在此图中再画出另外2种离子的物质的量的变化曲线并注明离子种类。
(3)在(2)反应后的溶液中加入含0.1molH2SO4的稀硫酸,计算还能产生的气体的体积(标况下)。
19.(1)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
①写出并配平该反应的化学方程式: ▲
②在该反应中,得电子的物质是 ▲ ,被氧化的元素是 ▲ 。
③在反应中,每转移1 mol电子,消耗HCl ▲ mol。
(2)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
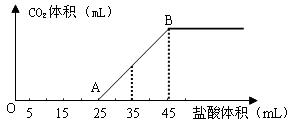
①写出OA段所发生反应的离子方程式______________________________________。
②当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com