
4.执行右边的程序框图,若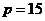 ,则输出的
,则输出的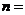 .
.
1. 已知集合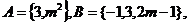 若
若 ,则实数m的值为
.2. 若复数
,则实数m的值为
.2. 若复数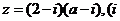 为虚数单位)为纯虚数,则实数a的值为 .
为虚数单位)为纯虚数,则实数a的值为 . 3. 长方形ABCD中,,AB=2,BC=1,O为AB的中点,在长方形ABCD内随机取一点,取到的点到O的距离大于1 的概率为___________.
3. 长方形ABCD中,,AB=2,BC=1,O为AB的中点,在长方形ABCD内随机取一点,取到的点到O的距离大于1 的概率为___________.
21.(12分)⑴第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 ▲ 。在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为 ▲ 。在四大晶体类型中,GaN属于 ▲ 晶体。
⑵铜、铁元素能形成多种配合物。微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有 ▲ 的原子或离子
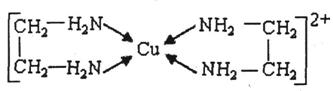 ⑶CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:
⑶CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:
① H、N、O三种元素的电负性由大到小的顺序是 ▲ 。
 ②SO2分子的空间构型为 ▲ 。与SnCl4互为等电子体的一种离子的化学式为 ▲
②SO2分子的空间构型为 ▲ 。与SnCl4互为等电子体的一种离子的化学式为 ▲
③乙二胺分子中氮原子轨道的杂化类型为 ▲ 。乙二胺和三甲胺均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 ▲ 。
④⑶中所形成的配离子中含有的化学键类型有 ▲ 。
a.配位键 b.极性键 c.离子键 d.非极性键
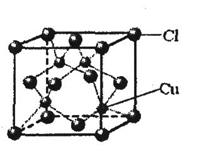
⑤CuCl的晶胞结构如右图所示,其中Cl原子的配位数为 ▲ 。
20.(10分)工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1: ▲ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为 ▲ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+--Mn2++Fe3++H2O(未配平)
①V的取值范围为 ▲ ;
②若V=35,试计算混合物中CuS的质量分数。
19.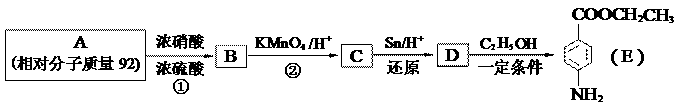 (12分)苯佐卡因是一种医用麻醉药品,学名对氨基苯甲酸乙酯。用芳香烃A为原料合成苯佐卡因E的路线如下:
(12分)苯佐卡因是一种医用麻醉药品,学名对氨基苯甲酸乙酯。用芳香烃A为原料合成苯佐卡因E的路线如下:
请回答:
⑴写出结构简式 B ▲ C ▲ 。
⑵写出反应类型 ① ▲ ② ▲ 。
⑶化合物D经聚合反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。写出该聚合反应的化学方程式:
▲ 。
⑷下列化合物中能与E发生化学反应的是 ▲ 。
a. HCl b. NaCl c. Na2CO3 d. NaOH
⑸除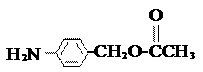 、
、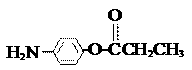 、
、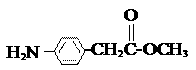 外,符合下列条件的化合物E的同分异构体有 ▲ 种。
外,符合下列条件的化合物E的同分异构体有 ▲ 种。
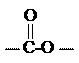 i. 为1,4-二取代苯,其中苯环上的一个取代基是氨基;
i. 为1,4-二取代苯,其中苯环上的一个取代基是氨基;
ii. 分子中含 结构的基团
18.(12分)近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
|
 ⑴汽车内燃机工作时引起反应:N2(g)+O2(g)
⑴汽车内燃机工作时引起反应:N2(g)+O2(g)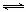 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数
K= ▲ 。(计算结果保留小数点后两位数字)
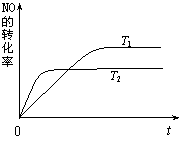
⑵一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如右图所示。(已知:T1<T2)
①反应 2NO(g) 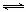 N2(g)+O2(g)为(填“吸热”或“放热”) ▲ 反应。
N2(g)+O2(g)为(填“吸热”或“放热”) ▲ 反应。
②一定温度下,能够说明反应 2NO(g) 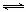 N2(g)+O2(g) 已达到平衡的是(填序号)▲ 。
N2(g)+O2(g) 已达到平衡的是(填序号)▲ 。
a.容器内的压强不发生变化 b.NO分解的速率和NO生成的速率相等
c.NO、N2、O2的浓度保持不变 d.单位时间内分解4 mol NO,同时生成2 mol N2
⑶①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2= ▲ 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 ▲ 。
17.(12分)重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等,以铬铁矿(主要成分为Cr2O3,还有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下:
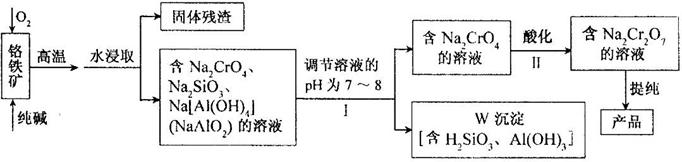
请回答下列问题。
⑴铬铁矿中的Cr2O3与纯碱、O2在高温下反应的化学方程式为 ▲ 。
⑵若Ⅰ中只用一种试剂调节溶液的pH,应选用 ▲ (填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
⑶Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是:
▲ 。(用离子方程式表示)。
⑷Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O
①该反应 ▲ (填“是”或“不是”)氧化还原反应。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液 ▲ (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是 ▲ 。
16.(10分)钨是高熔点金属,工业上用黑钨铁矿冶炼金属钨有多种方法,同时还可制得副产品高锰酸钾。已知WO3是钨的稳定氧化物,它不溶于水也不溶于酸,可用钨酸(H2WO4,黄色,不溶于水)或某些钨酸盐分解制得。其主要的工艺流程如下:

请根据图示及所学知识回答下列问题:
⑴写出反应④的化学方程式: ▲ 。
⑵写出反应⑨的离子方程式: ▲ 。
⑶方法二制WO3的过程中,需洗涤CaWO4,如何检验CaWO4已洗涤干净: ▲ 。
⑷整个工艺流程所涉及的物质中,属于酸性氧化物的有 ▲ 。
⑸写出反应⑩中阳极反应的电极反应式: ▲ 。
15.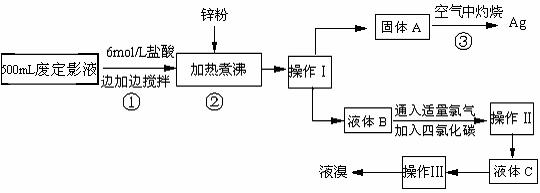 (10分)照相用的废定影液中含有Na+、3-、Br-等离子。某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴。(已知:4H++2 3- = Ag2S↓+3S↓+3SO2↑+SO42-+2H2O)
(10分)照相用的废定影液中含有Na+、3-、Br-等离子。某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴。(已知:4H++2 3- = Ag2S↓+3S↓+3SO2↑+SO42-+2H2O)
⑴操作Ⅲ的名称是 ▲ ;操作Ⅱ需要的主要玻璃仪器有 ▲ 。
⑵加入锌粉的目的是将少量溴化银中的银还原出来,该反应的离子反应方程式为 ▲。
⑶液体B中除含有Br-,还有SO42-,检验溶液中存在SO42-的操作是 ▲ 。
⑷步骤③实验操作时,也常采用加入适量硝酸钾加盖后再灼热的方法,推测加硝酸钾的目的可能是 ▲ 。
⑸通过上述回收银的流程中,从绿色化学的要求看,存在的不足为 ▲ 。
14.下列叙述正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c < c < c(NH4Cl)
B.无色透明的酸性溶液中,Cu2+、K+、SO42-、NO3- 能大量共存
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.NaHCO3溶液中:c(H+) + c(H2CO3)=c(CO32-) + c(OH-)
非选择题(共78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com