
5.(09广东理科基础 23)下列有关金属及其合金的说法不正确的是
23)下列有关金属及其合金的说法不正确的是
 A.目前我国流通的硬币是由合金材料制造的
A.目前我国流通的硬币是由合金材料制造的
 B.生铁、普通钢和不锈钢中的碳含量依次增加
B.生铁、普通钢和不锈钢中的碳含量依次增加
 C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
 D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
 答案:B
答案:B
 解析:
解析:
 生铁、普通钢和不锈钢中的碳含量依次降低,故B项错。
生铁、普通钢和不锈钢中的碳含量依次降低,故B项错。
4.(09浙江卷 10)已知:25°C时,
10)已知:25°C时,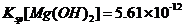 ,
,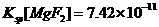 。下列说法正确的是
。下列说法正确的是
 A.25°C时,饱和
A.25°C时,饱和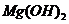 溶液与饱和
溶液与饱和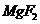 溶液相比,前者的
溶液相比,前者的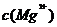 大
大
 B.25°C时,在
B.25°C时,在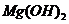 的悬浊液加入少量的
的悬浊液加入少量的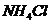 固体,
固体,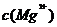 增大
增大
 C.25°C时,
C.25°C时,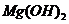 固体在20ml0.01 mol·
固体在20ml0.01 mol·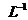 氨水中的
氨水中的 比在20mL0.01mol·
比在20mL0.01mol·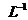
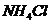 溶液中的
溶液中的 小
小
 D.25°C时,在
D.25°C时,在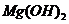 的悬浊液加入
的悬浊液加入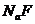 溶液后,
溶液后,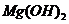 不可能转化成为
不可能转化成为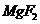
答案:B
解析:
A项, Mg(OH)2的溶度积小,故其电离出的Mg2+浓度要小一些,错;
B项, NH4+ 可以结合Mg(OH)2电离出的OH-离子,从而促使Mg(OH)2的电离平衡正
向移动,C(Mg2+)增大,正确。
C项, Ksp仅与温度有关,故错;
D项,由于MgF2的溶度积更小,所以沉淀会向更难溶的方向进行,即可以生成MgF2沉淀,正确。
3.(09江苏卷 5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
 A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
 B. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
 C.
C. 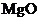 的熔点很高,可用于制作耐高温材料
的熔点很高,可用于制作耐高温材料
 D. 点解
D. 点解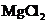 饱和溶液,可制得金属镁
饱和溶液,可制得金属镁
答案:D
解析:
 A项,明矾净水的原理是
A项,明矾净水的原理是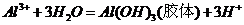 ,利用
,利用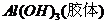 的吸附性进行净水;
的吸附性进行净水;
B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解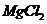 饱和溶液,发生地化学反应为
饱和溶液,发生地化学反应为 ,不会产生金属镁,电解熔融的
,不会产生金属镁,电解熔融的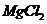 能制取单质镁,发生的反应
能制取单质镁,发生的反应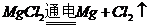 。
。
2.(09江苏卷
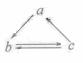 3)下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
3)下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
|
|
a |
b |
c |
|
A |
Al |
AlCl3 |
Al(OH)3 |
|
B |
HNO3 |
NO |
NO2 |
|
C |
Si |
SiO2 |
H2SiO3 |
|
D |
CH2=CH2 |
CH3CH2OH |
CH3CHO |
答案:B
解析:
A项: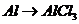
(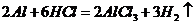 或者
或者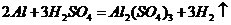 ,
,
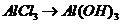 (
(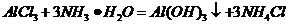 ),
),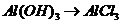 (
(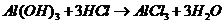 ),
),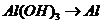 的转化必须经过
的转化必须经过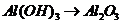 (反应方程式为:
(反应方程式为: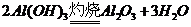 )和
)和 (
(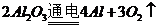 )这两步,所以A项不选;
)这两步,所以A项不选;
 B项:
B项: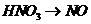 (
(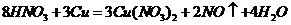 ),
), (
(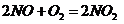 ),
),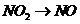 (
(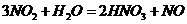 ),
),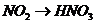 (
(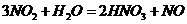 ),所以B项正确;
),所以B项正确;
 C项:
C项: (
( ),
),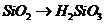 必须经过两步(
必须经过两步(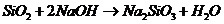 、
、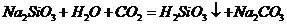 ),
),
 D项:
D项: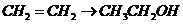 (
(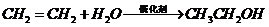 ),
),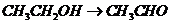 (
(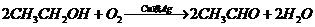 ),
),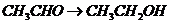 (
( ),
),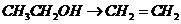 就必须经过两步(
就必须经过两步( 和
和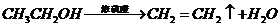 )
)
1.(09全国卷Ⅰ8)下列表示溶液中发生反应的化学方程式错误的是
A.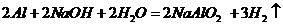
B.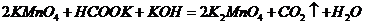
C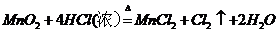
D.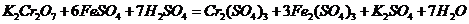
答案:B
解析:在碱性条件下,不可能产生CO2气体,而应是CO32 -,故B项错。
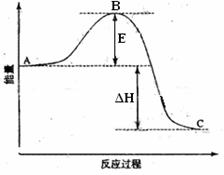
9.(09宁夏卷 28)(14分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
28)(14分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
 (1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
;
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
;
 (2)图中△H= KJ·mol-1;
(2)图中△H= KJ·mol-1;
 (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
 (4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)=
mol·L-1·min-1;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)=
mol·L-1·min-1;
 (5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
 答案:(1)反应物能量 生成物能量 (2)无 降低 因为催化剂改变了反应的历程使活化能E降低 (3)-198 (4) SO2
+V2O5=SO3+2VO2 4VO2+ O2=2V2O5 (4)0.025 0.05
答案:(1)反应物能量 生成物能量 (2)无 降低 因为催化剂改变了反应的历程使活化能E降低 (3)-198 (4) SO2
+V2O5=SO3+2VO2 4VO2+ O2=2V2O5 (4)0.025 0.05
 (5) S(s)+O2(g) =2SO2(g)△H1=-296
KJ·mol-1 , SO2(g)+1/2O2(g) =SO3(g) △H2=-99
KJ·mol-1
(5) S(s)+O2(g) =2SO2(g)△H1=-296
KJ·mol-1 , SO2(g)+1/2O2(g) =SO3(g) △H2=-99
KJ·mol-1
 3 S(s)+9/2O2(g)=3SO3(g) △H=3(△H1+△H2)=-1185
KJ·mol-1
3 S(s)+9/2O2(g)=3SO3(g) △H=3(△H1+△H2)=-1185
KJ·mol-1

 解析: (1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;(2)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1;(3)依题意即可写出:SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5;(4)依据速率之比等于化学计量数之比
解析: (1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;(2)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1;(3)依题意即可写出:SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5;(4)依据速率之比等于化学计量数之比
8.(09上海卷 30)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
30)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧: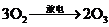
 (1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g/mol
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g/mol (保留一位小数)。
(保留一位小数)。
 (2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________L。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________L。
 (3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为__________________。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为__________________。
答案:
 (1)35.6
(1)35.6 (2)3
(2)3 (3)0.5
(3)0.5
[解析](1)假设有1mol O2,则
3O2 2O3
开始 1mol 0
反应 0.3mol 0.2mol
平衡 0.7mol 0.2mol
所以平均摩尔质量为: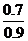 ×32g·mol-1+
×32g·mol-1+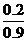 ×48g·mol-1=35.6g·mol-1
×48g·mol-1=35.6g·mol-1
(2)此题应根据差量法计算
3O2  2O3
2O3 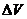
开始 8L 0
反应 4.5L 3L 1.5L
(3)n(混合气体)=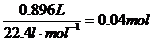
 设臭氧的体积分数为a,则根据氧原子守恒0.04mol·a·2+0.04mol·(1-a)·3=
设臭氧的体积分数为a,则根据氧原子守恒0.04mol·a·2+0.04mol·(1-a)·3=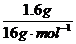
解得a=0.5
7.(09上海卷 26)根据硫化氢气体的实验室制法和性质完成下列填空。
26)根据硫化氢气体的实验室制法和性质完成下列填空。
 (1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用________。
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用________。
 a.稀硫酸与硫化亚铁
b.稀硝酸与硫化亚铁
a.稀硫酸与硫化亚铁
b.稀硝酸与硫化亚铁
 c.稀硫酸与硫化钠
d.稀盐酸与硫化亚铁
c.稀硫酸与硫化钠
d.稀盐酸与硫化亚铁
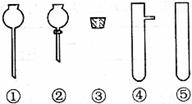
 (2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器;
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器;
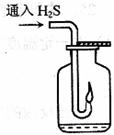
 ______________(填编号)。
______________(填编号)。





 (3)如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,
(3)如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液, 点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到
点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到
 的现象是___________________________________________________。
的现象是___________________________________________________。
 (4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
 ______________________________________________________________
______________________________________________________________
 反应过程中,溶液的pH______(填“变大”、“变小”或“不变”)。
反应过程中,溶液的pH______(填“变大”、“变小”或“不变”)。
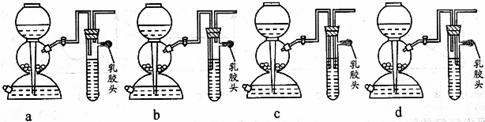
 (5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。

 (6)已知硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是______________________。
(6)已知硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是______________________。
答案: (1)a d
(1)a d  (2)② ③ ④
(2)② ③ ④ (3)品红溶液褪色:瓶壁有淡黄色粉末和无色的小液滴
(3)品红溶液褪色:瓶壁有淡黄色粉末和无色的小液滴 (4)
(4)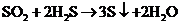 变大
变大 (5)b
(5)b (6)S H2O
(6)S H2O
[解析](1)若用启普发生器制取气体,所选试剂应为块状固体和液体,且反应不需要加热,故a、d正确,c错误。硝酸具有强氧化性,与硫化亚铁反应得不到H2S,b项错。
(2)要控制硫化氢气体产生速率必须选用分液漏斗。
(3)开始氧气充足,H2S燃烧生成SO2和H2O,后来氧气不足,燃烧产物为S和H2O,描述反应现象要从SO2、S和H2O三个方面考虑。
(5)a中增加的装置起不到任何作用。b装置可将启普发生器内的H2S与点燃的H2S分隔开,能防止爆炸。c、d装置中生成的H2S无法排出,故错误。
(6)当硫化氢在空气中的体积分数为30%时,O2在混合气体中的体积分数为70%×1、5=14%,O2不足,发生反应2H2S+O2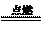 2S+2H2O。
2S+2H2O。
6.(09四川卷26)(16分) 过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化的含量
请填写下列空白:
(1) 移取10.00 m密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水衡释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2) 用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。

 MnO4-+
MnO4-+
 H2O2+
H2O2+
 H+=
H+=
 Mn2++
Mn2++
 H2O+
H2O+



(3)滴定时,将高锰酸钾标准溶液注入 (
(3) 滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________________________________________
______________________________________________________________。
(4) 复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
(5) 若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学举小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾演粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
|
实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
|
验证氧化性 |
|
|
|
验证不稳定性 |
|
|
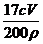 答案:
答案: mI.(1)容量瓶(2)2 5 6 2 8 502(3)酸式
mI.(1)容量瓶(2)2 5 6 2 8 502(3)酸式
滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色(4)
(5)偏高
II.(各1分,共4分)
|
实验内容 |
实验方法 |
实验现象 |
|
验证氧化性 |
取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液。 (取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液。) |
产生淡黄色沉淀或溶液变浑浊。 (溶液变蓝色。) |
|
验证不稳定性 |
取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验。 (取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中。) |
产生气泡,木条复燃。 (溶液变浑浊或有浅黄色沉淀产生) |
 [解析]I.(1)仪器的选用根据题意应该选用容量瓶。(2)残缺方程式配平首先确定缺什么,分析可知缺的是O2,根据电子转移守恒,配平化学方程式。
[解析]I.(1)仪器的选用根据题意应该选用容量瓶。(2)残缺方程式配平首先确定缺什么,分析可知缺的是O2,根据电子转移守恒,配平化学方程式。
 (3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管。滴定到达终点的现象是:滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色。(4)根据配平的化学方程式计算出过氧化氢的量,最后计算出原过氧化氢溶液中过氧化氢的质量分数为17Cv/200ρ。(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。
(3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管。滴定到达终点的现象是:滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色。(4)根据配平的化学方程式计算出过氧化氢的量,最后计算出原过氧化氢溶液中过氧化氢的质量分数为17Cv/200ρ。(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。
II.(1)验证氧化性,选用具有还原性的饱和硫化氢溶液,产生淡黄色沉淀硫或溶液变浑浊;或者选用有还原性的碘化钾淀粉溶液,有碘单质生成,溶液变蓝色。(2)验证不稳定性,取适量过氧化氢溶液于试管中,加热,用带火星的木条检验有氧气生成;或者取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中,溶液变浑浊或有浅黄色沉淀产生。
[点评] 本题属于化学实验综合运用问题,考查的知识点众多,涉及到氧化还原反应以及配平、
本题属于化学实验综合运用问题,考查的知识点众多,涉及到氧化还原反应以及配平、 化学实验操作、滴定的误差分析以及气体的制备等。
化学实验操作、滴定的误差分析以及气体的制备等。
5.(09北京卷28)(15分)以黄铁矿为原料生产硫酸的工艺流程图如下:
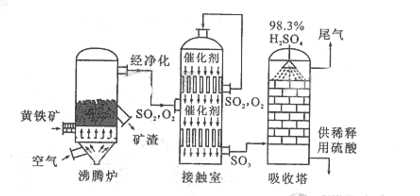
(1)将燃烧黄铁矿的化学方程式补充完整 4 +11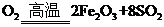
(2)接触室中发生反应的化学方程式是 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a. 为使黄铁矿充分燃烧,需将其粉碎
b. 过量空气能提高 的转化率
的转化率
c. 使用催化剂能提高 的反应速率和转化率 d. 沸腾炉排出的矿渣可供炼铁
的反应速率和转化率 d. 沸腾炉排出的矿渣可供炼铁
(4)每160g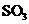 气体与
气体与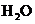 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的 和铵盐。
和铵盐。
① 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的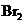 。
。 吸收
吸收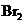 的离子方程式是
。
的离子方程式是
。
②
为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的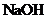 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %; 若铵盐质量为15.00g。 浓硫酸增加的质量为 。 (计算结果保留两位小数)
答案:
 (1)FeS2
(1)FeS2 (2)
(2)
 (3)a b d
(3)a b d (4)SO3(g) + H2O(l) = H2SO4(l);ΔH=-130.3kJ/mol
(4)SO3(g) + H2O(l) = H2SO4(l);ΔH=-130.3kJ/mol (5)①SO2 + Br2 + 2H2O = 4H+ +
2Br- + SO42-
(5)①SO2 + Br2 + 2H2O = 4H+ +
2Br- + SO42- ②14.56
2.31g
②14.56
2.31g

 [解析]本题主要考查硫酸工业、热化学方程式的书写、计算等。
[解析]本题主要考查硫酸工业、热化学方程式的书写、计算等。
 (1)根据原子守恒即可判断该物质为FeS2。
(1)根据原子守恒即可判断该物质为FeS2。
 (2)SO2和O2在接触室发生反应生成SO3:2SO2 + O2
(2)SO2和O2在接触室发生反应生成SO3:2SO2 + O2 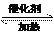 2SO3。
2SO3。
 (3)选项a,将黄铁矿粉碎更增加反应接触面积而加快反应速率。选项b,增加空气(O2)浓度能提高SO2的转化率。选项c,催化剂对转化率无影响。选项d,矿渣中含有Fe2O3,可用于冶炼铁。
(3)选项a,将黄铁矿粉碎更增加反应接触面积而加快反应速率。选项b,增加空气(O2)浓度能提高SO2的转化率。选项c,催化剂对转化率无影响。选项d,矿渣中含有Fe2O3,可用于冶炼铁。
 (4)160g SO3(g)与H2O(l)反应生成H2SO4(l)放出260.6kJ热量,则1mol SO3(g)与H2O(l)反应生成H2SO4(l)放出130.3kJ热量,则相关热化学方程式为: SO3(g) + H2O(l)=H2SO4(l);△H=-130.3kJ/mol。
(4)160g SO3(g)与H2O(l)反应生成H2SO4(l)放出260.6kJ热量,则1mol SO3(g)与H2O(l)反应生成H2SO4(l)放出130.3kJ热量,则相关热化学方程式为: SO3(g) + H2O(l)=H2SO4(l);△H=-130.3kJ/mol。
 (5)10g时说明铵盐不足,20g时说明氢氧化钠不足,由10.00g和20.00g 时浓硫酸增加的质量相同说明铵盐有酸式根产生的氨气, 氢氧化钠的物质的量浓度为Cmol/L
(5)10g时说明铵盐不足,20g时说明氢氧化钠不足,由10.00g和20.00g 时浓硫酸增加的质量相同说明铵盐有酸式根产生的氨气, 氢氧化钠的物质的量浓度为Cmol/L
 设10克中有Xmol的 (NH4)2SO4 和ymol的NH4HSO4则
设10克中有Xmol的 (NH4)2SO4 和ymol的NH4HSO4则
 132X + 115y=10…………………………………………………….(1)
132X + 115y=10…………………………………………………….(1)
 10g时说明铵盐不足由N守恒知
10g时说明铵盐不足由N守恒知
 n(NH3)=2X + y
n(NH3)=2X + y
 20g时铵盐已经过量,氢氧化钠先和酸式根反应,则(NH4)2SO4为2Xmol,2ymol的NH4HSO4
20g时铵盐已经过量,氢氧化钠先和酸式根反应,则(NH4)2SO4为2Xmol,2ymol的NH4HSO4
 HSO4- + OH- = SO42- + H2O
HSO4- + OH- = SO42- + H2O
 1 1
1 1
 2y 2y
2y 2y
 NH4+ + OH- = NH3 +
H2O
NH4+ + OH- = NH3 +
H2O
 1
1
1
1
 50C×10-3-2y 50C×10-3-2y
50C×10-3-2y 50C×10-3-2y
 由于产生的氨气一样多
由于产生的氨气一样多
 n(NH3)=2X
+ y=50C×10-3-2y………………………………….(2)
n(NH3)=2X
+ y=50C×10-3-2y………………………………….(2)
 30g时铵盐过量,则(NH4)2SO4为3Xmol,3ymol的NH4HSO4 n(NH3)=0.68/17=0.04mol
30g时铵盐过量,则(NH4)2SO4为3Xmol,3ymol的NH4HSO4 n(NH3)=0.68/17=0.04mol
 HSO4- + OH- = SO42- + H2O
HSO4- + OH- = SO42- + H2O
 1 1
1 1
 3y 3y
3y 3y
 NH4+ + OH- =
NH3
+ H2O
NH4+ + OH- =
NH3
+ H2O
 1
1
1
1
 50C×10-3-3y
0.04
50C×10-3-3y
0.04
 所以
所以
 50C×10-3-3y=0.04…………………………………………………….(3)
50C×10-3-3y=0.04…………………………………………………….(3)
 联立(1) (2) (3)解得
联立(1) (2) (3)解得
 X=0.02mol y=0.064mol C=4.64mol/L
X=0.02mol y=0.064mol C=4.64mol/L
 氮的质量百分含量=
氮的质量百分含量= 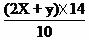 ×100%=(0.04+0.064) ×14/10×100%=14.56%
×100%=(0.04+0.064) ×14/10×100%=14.56%
 15g时铵盐已经过量,则(NH4)2SO4为1.5Xmol,1.5 ymol的NH4HSO4
15g时铵盐已经过量,则(NH4)2SO4为1.5Xmol,1.5 ymol的NH4HSO4
 HSO4- + OH- = SO42- + H2O
HSO4- + OH- = SO42- + H2O
 1
1
1
1
 1.5y 1.5y
1.5y 1.5y
 NH4+ + OH- =
NH3
+ H2O
NH4+ + OH- =
NH3
+ H2O
 1
1
1
1
 50C×10-3-1.5y 50C×10-3-1.5y
50C×10-3-1.5y 50C×10-3-1.5y
 n(NH3)= 50C×10-3-1.5y=50×4.64×10-3-1.5×0.064=0.136mol
n(NH3)= 50C×10-3-1.5y=50×4.64×10-3-1.5×0.064=0.136mol
 m(NH3)=0.136×17=2.31g
m(NH3)=0.136×17=2.31g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com