
20.(09年浙江理综·28)[15分]单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;
装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+ 5Fe3++Mn2++4H2O
5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol/L KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是 。
答案:[15分]
(1)MnO2+4H++2Cl― Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)平衡压强,使液体顺利流出并防止漏气;浓硫酸;产物SiCl4沸点低,需要冷凝收集;
(3)Al、P、Cl;
(4)①否;KMnO4溶液的紫红色可指示反应终点;②4.480%;
21 .(09年天津理综·9)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
.(09年天津理综·9)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:

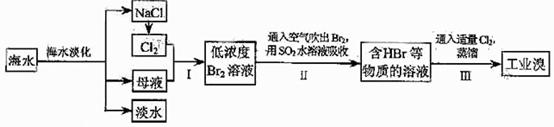
 (1)请列举海水淡化的两种方法: 、 。
(1)请列举海水淡化的两种方法: 、 。
 (2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
 (3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为
。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为
。
 (4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是
。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是
。
 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:


 请你参与分析讨论:
请你参与分析讨论:
 ①图中仪器B的名称:
。
①图中仪器B的名称:
。
 ②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
 ③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
 ④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
。
答案:(1)蒸馏法、电渗析法、离子交换法及其其他合理答案中的任意两种
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O=4H++SO42-+2Br- 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶③控制温度计b的温度,并收集59℃的馏分④深红棕色 分液(或蒸馏)
19.(09年重庆理综·27)(15分)两个学习小组用题27图装置探究乙二酸(HOOC-COOH)受热分解的部分产物。
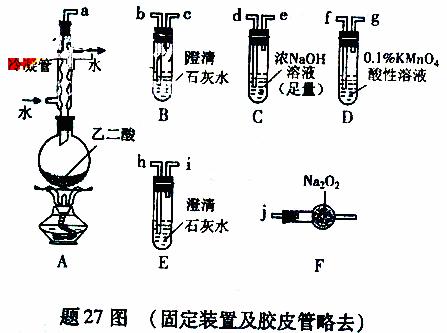
(1)甲组:
①按接口顺序:a-b-c-d-e-f-g-h连接装置进行实验。B中溶液变浑浊,证明分解产物有 ;装置C的作用是 ;E中溶液变浑浊,D中的现象是 ,证明分解产物有 。
②乙二酸受热分解的化学方程式为 。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为 。
②从A-F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。
最简单的装置接口连接顺序是 ;实验后用F中的固体进行验证的方法是 (可另选试剂)。
答案:(1)①CO2;充分除去CO2;溶液褪色或变浅;CO
②HOOC-COOH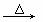 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)①2Na2O2+2CO2=2Na2CO3+O2
②a→d→e→j;取F中的固体,滴加稀硫酸,将生成的气体通入澄清石灰水,若变浑浊,则发生了反应,若不浑浊,则未发生反应。
18.(09年重庆理综·7)有关实验的叙述,正确的是
A. 将固体加入容量瓶中溶解并稀释至刻度,配置成一定物质的量浓度的溶液
B. 用玻璃棒蘸取溶液,点在湿润的pH是指上测定其pH
C. 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D. 读取滴定管内液体的体积,俯视读数导致读数偏小
答案:D
1.(09年浙江理综·13)下列说法正确的是
A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
C.乙酸与乙醇的混合液可用分液漏斗进行分离
D.用标准盐酸滴定待测NaOH溶液时,水洗后的酸式滴定管未经标准液润洗,
则测定结果偏低
答案:B
16.(09年四川理综·7)下列有关物质检验的实验结论正确的是
|
选项 |
实 验 操 作 及 现 象 |
实 验 结 论 |
|
A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
|
B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
|
C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
|
D |
将少量某物质的溶液滴加到新制的银溶液中,水浴加热后有银镜生成 |
该物质一定属于醛类 |
答案:B
17 .(09年天津理综·3)下列实验设计和结论相符的是
.(09年天津理综·3)下列实验设计和结论相符的是
 A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
 B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
 C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
 D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
答案:B
13.(09年上海化学·6)下列实验装置不适用于物质分离的是

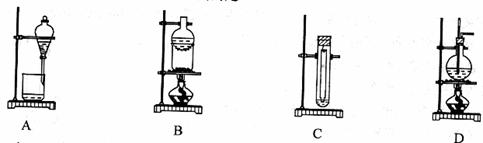
答案:D
 14
14 .(09年上海化学·11)1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度
.(09年上海化学·11)1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度 为115-125℃,反应装置如右图。下列对该实验的描述错误的是
为115-125℃,反应装置如右图。下列对该实验的描述错误的是
 A.不能用水浴加热
A.不能用水浴加热
 B.长玻璃管起冷凝回流作用
B.长玻璃管起冷凝回流作用
 C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
 D.加入过量乙酸可以提高1-丁醇的转化率
D.加入过量乙酸可以提高1-丁醇的转化率
答案:C
15 .(09年上海化学·16)物质的鉴别有多种方法。下列能达到鉴别目的的是
.(09年上海化学·16)物质的鉴别有多种方法。下列能达到鉴别目的的是
 ①用水鉴别苯、乙醇、溴苯
①用水鉴别苯、乙醇、溴苯
 ②用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液
②用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液
 ③点燃鉴别甲烷和乙炔
③点燃鉴别甲烷和乙炔
 A.①② B.①③ C.②③ D.①②③
A.①② B.①③ C.②③ D.①②③
答案:B
10.(09年海南化学·3)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是:
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
答案:A
11
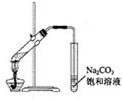 .(09年江苏化学·6)下列有关试验操作的叙述正确的是
.(09年江苏化学·6)下列有关试验操作的叙述正确的是
 A.实验室常用右图所示的装置制取少量的乙酸乙酯
A.实验室常用右图所示的装置制取少量的乙酸乙酯
 B.用50mL酸式滴定管可准确量取25.00mLKMnO4溶液
B.用50mL酸式滴定管可准确量取25.00mLKMnO4溶液
 C.用量筒取5.00mL 1.00mol·L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100 mol·L-1盐酸
C.用量筒取5.00mL 1.00mol·L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100 mol·L-1盐酸
 D.在苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
D.在苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
 答案:B
答案:B
 12
12 .(09年江苏化学·9)下列化学实验事实及其解释都正确的是
.(09年江苏化学·9)下列化学实验事实及其解释都正确的是
 A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
 B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
 C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
 D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1
AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp
D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1
AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp
 答案:AD
答案:AD
9.(09年海南化学·1)将等体积的苯、汽油和水在试管中充分混合后静置。下列图示现象正确的是:

答案:D
8.(09年广东文基·64)图l0装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
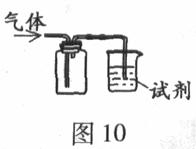
|
选项 |
试剂 |
现象 |
结论 |
|
A |
酸性KMnO4溶液 |
溶液褪色 |
SO2有氧化性 |
|
B |
品红溶液 |
溶液褪色 |
SO2有漂白性 |
|
C |
NaOH溶液 |
无明显现象 |
SO2与NaOH溶液不反应 |
|
D |
紫色石蕊试液 |
溶液变红后不褪色 |
SO2有酸性、没有漂白性 |
答案:B
7.(09年广东文基·63)下列处理事故的方法正确的是
A.金属钠着火,可用水扑灭
B.误食硫酸铜溶液,可服用鸡蛋清解毒
C.浓硫酸溅到皮肤上,立即用碳酸钠稀溶液冲洗
D.氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com