
8. (09广东化学
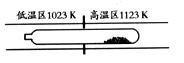
(09广东化学 7)难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
7)难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
 TaS2 (s)+2I2 (g)
TaS2 (s)+2I2 (g)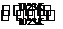 TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)
 下列说法正确的是
下列说法正确的是
 A.在不同温度区域,TaI4 的量保持不变
A.在不同温度区域,TaI4 的量保持不变
 B. 在提纯过程中,I2 的量不断减少
B. 在提纯过程中,I2 的量不断减少
 C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
 D. 该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
D. 该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
 答案:C
答案:C
 解析:
解析: 根据反应条件可知当温度不同时反应进行的主要方向不同所以A错误。
根据反应条件可知当温度不同时反应进行的主要方向不同所以A错误。
因为是在同一密闭系统中有质量守恒定律可知I2的量不可能不断减少,而是充当一个“搬运工”的角色,将TaS2从高温区转移到低温区,B错误。
根据平衡常数表达式可知K与Tal4 和S2 的浓度乘积成正比,D错误。
7.(09福建卷 12)某探究小组利用丙酮的溴代反应:(
12)某探究小组利用丙酮的溴代反应:( )来研究反应物浓度与反应速率的关系。反应速率
)来研究反应物浓度与反应速率的关系。反应速率 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:

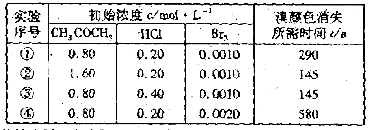
 分析实验数据所得出的结论不正确的是
分析实验数据所得出的结论不正确的是
 A. 增大
A. 增大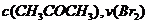 增大 B. 实验②和③的
增大 B. 实验②和③的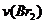 相等
相等
 C. 增大
C. 增大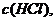
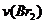 增大
D. 增大
增大
D. 增大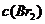 ,
,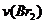 增大
增大
答案:D
解析:从表中数据看,①④中CH3COCH3,HCl的浓度是相同的,而④中Br2比①中的大,所以结果,时间变长,即速率变慢了,D项错。其他选项依次找出表中两组相同的数据,看一变量对另一变量的影响即可。
6.(09福建卷 10)
在一定条件下,Na2CO3溶液存在水解平衡:
10)
在一定条件下,Na2CO3溶液存在水解平衡:
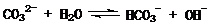 。下列说法正确的是
。下列说法正确的是
 A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
C. 升高温度,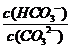 减小
D. 加入NaOH固体,溶液PH减小
减小
D. 加入NaOH固体,溶液PH减小
答案:B
解析:平衡常数仅与温度有关,故稀释时是不变的,A项错;CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确;升温,促进水解,平衡正向移动,故表达式的结果是增大的,C项错;D项,加入NaOH,碱性肯定增强,pH增大,故错。
5.(09广东理科基础 29)已知汽车尾气无害化处理反应为
29)已知汽车尾气无害化处理反应为

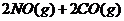


 下列说法不正确的是
下列说法不正确的是
 A.升高温度可使该反应的逆反应速率降低
A.升高温度可使该反应的逆反应速率降低
 B.使用高效催化剂可有效提高正反应速率
B.使用高效催化剂可有效提高正反应速率
 C.反应达到平衡后,N0的反应速率保持恒定
C.反应达到平衡后,N0的反应速率保持恒定
 D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
 答案:A
答案:A
 解析:
解析: 升温,无论是正反应,还是逆反应,速率均加快,A项错;催化剂可以加快化学反应速率,B项正确;达平衡后,各组分的速率保持不变,C项正确;由于CO和CO2的计量系数相等,故当两者同时消耗的量相等时,反应即达平衡,D项正确。
升温,无论是正反应,还是逆反应,速率均加快,A项错;催化剂可以加快化学反应速率,B项正确;达平衡后,各组分的速率保持不变,C项正确;由于CO和CO2的计量系数相等,故当两者同时消耗的量相等时,反应即达平衡,D项正确。
4. (09江苏卷
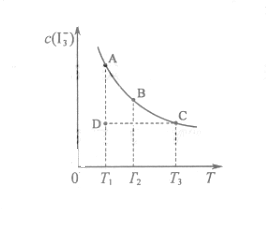
(09江苏卷 14)I2在KI溶液中存在下列平衡:
14)I2在KI溶液中存在下列平衡:

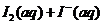

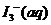
 某I2、、KI混合溶液中,
某I2、、KI混合溶液中,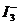 的物质的量浓度c(
的物质的量浓度c(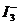 )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是

 A. 反应
A. 反应
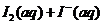

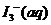 的△H>0
的△H>0
 B.若温度为
B.若温度为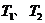 ,反应的平衡常数分别为
,反应的平衡常数分别为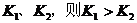
 C.若反应进行到状态D时,一定有
C.若反应进行到状态D时,一定有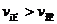
 D.状态A与状态B相比,状态A的c(I2)大
D.状态A与状态B相比,状态A的c(I2)大
 答案:BC
答案:BC
 解析:
解析:
随着温度的不断升高, 的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以
的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以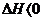 ,所以A项错;
,所以A项错;
因为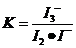 ,
,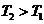 ,所以当温度升高时,反应向逆方向移动,即
,所以当温度升高时,反应向逆方向移动,即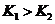 ;C项,
;C项,
从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时 的浓度在增加,所以
的浓度在增加,所以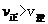 ,C项正确;D项,从状态A到状态B,
,C项正确;D项,从状态A到状态B, 的浓度在减小,那么
的浓度在减小,那么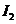 的浓度就在增加。
的浓度就在增加。
3.(09天津卷 5)人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2
5)人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO ,37 ℃时,该反应的平衡常数K=220
。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO ,37 ℃时,该反应的平衡常数K=220
。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
 A.CO与HbO2反应的平衡常数K=
A.CO与HbO2反应的平衡常数K=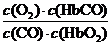
 B.人体吸入的CO越多,与血红蛋白结合的O2越少
B.人体吸入的CO越多,与血红蛋白结合的O2越少
 C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
 D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
 答案:C
答案:C
 解析:由反应方程式知,K的表达式正确,A对;CO与HbO2反应的平衡常数达220,可见其正向进行的程度很大,正确。K=
解析:由反应方程式知,K的表达式正确,A对;CO与HbO2反应的平衡常数达220,可见其正向进行的程度很大,正确。K=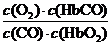
 ,由题意知,K=220,
,由题意知,K=220, 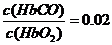 时,人受损,则C(CO)/C(O2)=9×10-5,C项错。D项,当O2浓度很大时,题
时,人受损,则C(CO)/C(O2)=9×10-5,C项错。D项,当O2浓度很大时,题 中平衡将逆向移动,从而解救人,正确。
中平衡将逆向移动,从而解救人,正确。
2.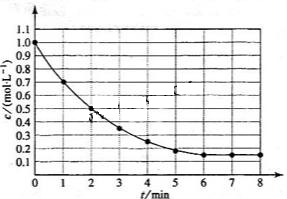 (09全国卷Ⅰ13)下图表示反应
(09全国卷Ⅰ13)下图表示反应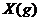

 ,
,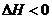 ,在某温度时
,在某温度时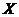 的浓度随时间变化的曲线:
的浓度随时间变化的曲线:
下列有关该反应的描述正确的是
A.第6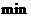 后,反应就终止了
后,反应就终止了
B.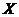 的平衡转化率为85%
的平衡转化率为85%
C.若升高温度,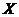 的平衡转化率将大于85%
的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减少
 答案:B
答案:B
 解析:A项,6min时反应达平衡,但未停止,故错;
解析:A项,6min时反应达平衡,但未停止,故错;
B项,X的变化量为1-0.15=0.85mol,转化率为0.85/1=85%,正确。
H<0,反应为放热,故升高温度,平衡将逆向移动,则X的转化率减小,C项错;D项,降温,正、逆反应速率同时减小,但是降温平衡正向移动,故V正>V逆,即逆反应减小的倍数大,错误。
1.(09安徽卷11) 汽车尾气净化中的一个反应如下:
汽车尾气净化中的一个反应如下:

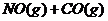

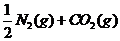
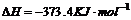
 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:
 答案:C
答案:C
 解析:该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,A选项错误;
解析:该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,A选项错误;
同理,升高温度,平衡逆向移动,CO的转化率减小,B选项错误;
平衡常数只与热效应有关,与物质的量无关,C选项正确;
增加氮气的物质的量,平衡逆向移动,NO的转化率减小,D选项错误。
39. (09年安徽理综·28)(17分)
(09年安徽理综·28)(17分)
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和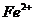 浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
 [实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。

 (1)请完成以下实验设计表(表中不要留空格)。
(1)请完成以下实验设计表(表中不要留空格)。
实验 编号 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
 |
298 |
10 |
6.0 |
0.30 |
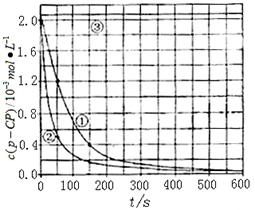
 [数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
 (2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
 v(p-CP)= mol·L-1·s-1。
v(p-CP)= mol·L-1·s-1。
 [解释与结论]
[解释与结论]
 (3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
 (4)实验③得出的结论是:PH等于10时,
。
(4)实验③得出的结论是:PH等于10时,
。
 [思考与交流]
[思考与交流]
 (5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:

 答案:
答案:
 (1)
(1)


 (2)8.0×10-6
(2)8.0×10-6
 (3)过氧化氢在温度过高时迅速分解。
(3)过氧化氢在温度过高时迅速分解。
 (4)反应速率趋向于零(或该降解反应趋于停止)
(4)反应速率趋向于零(或该降解反应趋于停止)
 (5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷等其他合理答案均可)
(5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷等其他合理答案均可)
38.(09年北京理综·27)(14分)
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
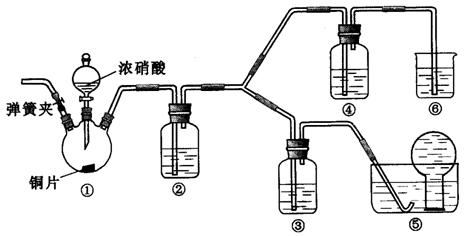

可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应。
2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是
。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后
 。
。
(3)装置①中发生反应的化学方程式是  。
。
(4)装置②的作用是
,发生反应的化学方程式是
。
(5)该小组得出的结论所依据的实验现象是
。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液 中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通人浓硝酸与铜反应产生的气体,观察颜色变化
答案:(14分)(1)3mol·L-1稀硝酸、浓硝酸、氢氧化钠溶液(2)通入CO2 一段时间,关闭弹簧夹,将装置⑤中的导管末端伸入倒置的烧瓶内(3)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(4)将NO2 转化为NO 3NO3+H2O=2HNO3+NO(5)装置③中液面上方气体仍为无色,装置④中液面上方气体有无色变为红棕色(6)acd
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com