
7.(09上海卷 20)对于常温下pH为1的硝酸溶液,下列叙述正确的是
20)对于常温下pH为1的硝酸溶液,下列叙述正确的是
 A.该溶液lmL稀释至100mL后,pH等于3
A.该溶液lmL稀释至100mL后,pH等于3
 B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
 C.该溶液中硝酸电离出的
C.该溶液中硝酸电离出的 与水电离出的
与水电离出的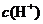 之比值为
之比值为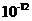 。
。
 D.该溶液中水电离出的
D.该溶液中水电离出的 是pH为3的硝酸中水电离出的
是pH为3的硝酸中水电离出的 的100倍
的100倍
答案:AB
[解析]硝酸为强电解质,完全电离,稀释100倍,pH增大2,A项正确。硝酸电离出的c(H+)为0.1 mol/l,与水电离出的c(H+)为10-13 mol/l,二者之比应为1012,C项错。pH为3的硝酸中水电离出的c(H+)为10-11mol/l,故D项的比值应为1:100,D项错。
6.(09上海卷 7)在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
7)在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
 A.①②③ B.②①③ C.③②① D.③①②
A.①②③ B.②①③ C.③②① D.③①②
答案:A
[解析]大气固氮是指在放电条件下将游离态的氮气转化为一氧化氮的过程,氮元素被氧化。硝酸银分解过程中氮元素化合价降低,被还原。实验室制氨气的反应不属于氧化还原反应,故A项正确。
5.(09上海卷4)用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.③④ D.②④
答案:B
[解析]氯化铵分解吸收热量,能降低火焰温度,并且分解产物氯化氢和氨气能隔绝空气,均破坏了可燃物的燃烧条件,故能使幕布不宜着火。
4.(09广东化学 15)取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
15)取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应: 2NO2(g)
2NO2(g) N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是

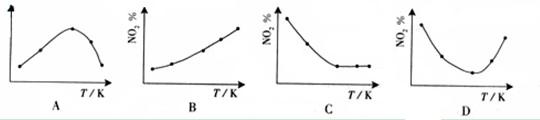
 答案:BD
答案:BD
 解析:
解析: 在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间。那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应移动。若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,所以B正确。若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,D正确。
在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间。那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应移动。若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,所以B正确。若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,D正确。
3.(09广东理科基础 29)已知汽车尾气无害化处理反应
29)已知汽车尾气无害化处理反应

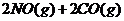
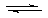
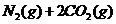
 。
。 下列说法不正确的是
下列说法不正确的是
 A.升高温度可使该反应的逆反应速率降低
A.升高温度可使该反应的逆反应速率降低
 B.使用高效催化剂可有效提高正反应速率
B.使用高效催化剂可有效提高正反应速率
 C.反应达到平衡后,N0的反应速率保持恒定
C.反应达到平衡后,N0的反应速率保持恒定
 D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
 答案:A
答案:A
 解析:升温,无论是正反应,还是逆反应,速率均加快,A项错;
解析:升温,无论是正反应,还是逆反应,速率均加快,A项错;
催化剂可以加快化学反应速率,B项正确;
达平衡后,各组分的速率保持不变,C项正确;
由于CO和CO2的计量系数相等,故当两者同时消耗的量相等时,反应即达平衡,D项正确。
1.
 (09全国卷Ⅱ6) 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
(09全国卷Ⅱ6) 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是

 A. 1:4 B.1:5 C. 2:3 D.2:5
A. 1:4 B.1:5 C. 2:3 D.2:5

 答案:A
答案:A
 解析:设2molZn参与反应,因Zn无剩余,则最终生成了2molZn(NO3)2,显然含有4molNO3- ,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。
解析:设2molZn参与反应,因Zn无剩余,则最终生成了2molZn(NO3)2,显然含有4molNO3- ,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。
2.(09江苏卷
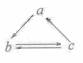 3)下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
3)下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
|
|
a |
b |
c |
|
A |
Al |
AlCl3 |
Al(OH)3 |
|
B |
HNO3 |
NO |
NO2 |
|
C |
Si |
SiO2 |
H2SiO3 |
|
D |
CH2=CH2 |
CH3CH2OH |
CH3CHO |
答案:B
 解析:A项:
解析:A项: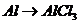 (
(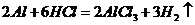 或者
或者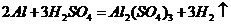 ,
,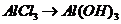 (
(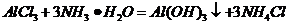 ),
),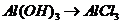 (
(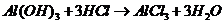 ),
),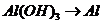 的转化必须经过
的转化必须经过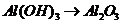 (反应方程式为:
(反应方程式为: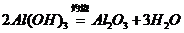 )和
)和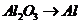 (
(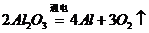 )这两步,所以A项不选;
)这两步,所以A项不选;
 B项:
B项: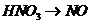 (
(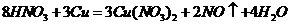 ),
),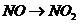 (
(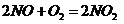 ),
),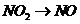 (
(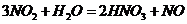 ),
),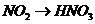 (
(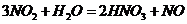 ),所以B项正确;
),所以B项正确;
 C项:
C项: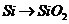 (
(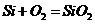 ),
),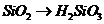 必须经过两步
必须经过两步
(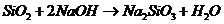 、
、 ),
),
 D项:
D项: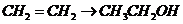 (
(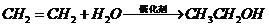 ),
),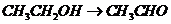 (
( ),
),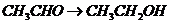 (
( ),
),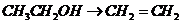 就必须经过两步(
就必须经过两步( 和
和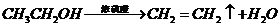 )
)
22.(10分)甲酸甲酯水解反应方程式为:

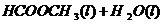
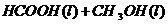
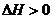
 某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:


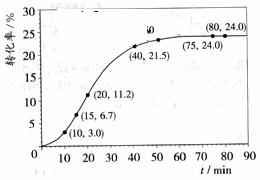
 甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:


 (1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:


 请计算15~20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率
请计算15~20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率
 为 mol·min-1(不要求写出计算过程)。
为 mol·min-1(不要求写出计算过程)。
 (2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:
。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:
。
 (3)上述反应的平衡常数表达式为:
(3)上述反应的平衡常数表达式为: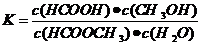 ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
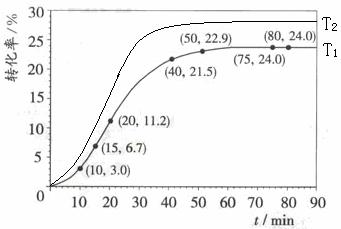
 (4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
 答案:(1)0.045 9.0×10-3
答案:(1)0.045 9.0×10-3  (2)该反应中甲酸具有催化作用
(2)该反应中甲酸具有催化作用
 ①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢。
①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢。
 ②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大。
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大。 ③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零。
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零。 (3)0.14
(3)0.14
 (4)
(4)
 解析:
解析: (1)15min时,甲酸甲酯的转化率为6.7%,所以15min时,甲酸甲酯的物质的量为1-1.00mol×6.7%==0.933mol;20min时,甲酸甲酯的转化率为11.2%所以20min时,甲酸甲酯的物质的量为1-1.00mol×11.2%==0.888mol,所以15至20min甲酸甲酯的减少量为0.933mol-0.888mol=0.045mol,则甲酸甲酯的平均速率=0.045mol/5min==0.009mol·min-1。
(1)15min时,甲酸甲酯的转化率为6.7%,所以15min时,甲酸甲酯的物质的量为1-1.00mol×6.7%==0.933mol;20min时,甲酸甲酯的转化率为11.2%所以20min时,甲酸甲酯的物质的量为1-1.00mol×11.2%==0.888mol,所以15至20min甲酸甲酯的减少量为0.933mol-0.888mol=0.045mol,则甲酸甲酯的平均速率=0.045mol/5min==0.009mol·min-1。
21.(09浙江卷 27)(15分)超音速飞机在平流层飞行时,尾气中的
27)(15分)超音速飞机在平流层飞行时,尾气中的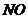 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的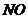 和
和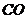 转变成
转变成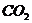 和
和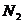 ,化学方程式如下:
,化学方程式如下:


 为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:

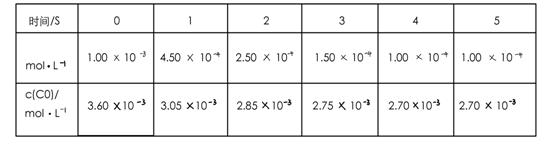

 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
 (1)在上述条件下反应能够自发进行,则反应的
(1)在上述条件下反应能够自发进行,则反应的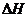 0(填写“>”、“<”、“=”。
0(填写“>”、“<”、“=”。
 (2)前2s内的平均反应速率v(N2)=_____________。
(2)前2s内的平均反应速率v(N2)=_____________。
 (3)在该温度下,反应的平衡常数K=
。
(3)在该温度下,反应的平衡常数K=
。
 (4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
。
 A.选用更有效的催化剂
B.升高反应体系的温度
A.选用更有效的催化剂
B.升高反应体系的温度
 C.降低反应体系的温度
D.缩小容器的体积
C.降低反应体系的温度
D.缩小容器的体积
 (5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。

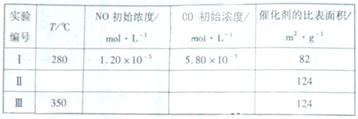
 ①请在上表格中填入剩余的实验条件数据。
①请在上表格中填入剩余的实验条件数据。
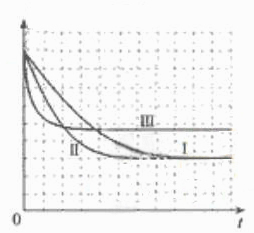
 ②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。

 答案:(1)< (2)
1.88×10-4mol/(L·s) (3)5000 (4)C、D
答案:(1)< (2)
1.88×10-4mol/(L·s) (3)5000 (4)C、D (5)①II:
280、1.20×10-3、5.80×10-3
(5)①II:
280、1.20×10-3、5.80×10-3 Ⅲ:1.2×10-3
、5.80×10-3
Ⅲ:1.2×10-3
、5.80×10-3
 ②
②

 解析:(1)自发反应,通常为放热反应,即H小于0。(2)以NO计算,2s内NO的浓度变化为(10-2.5)×10-4mol/L,V(NO)=7.5×10-4/2
=3.75×10-4mol/(L·s)。根据速率之比等于计量系数比可知,V(N2)=1/2 V(NO)=1.875×10-4mol/(L·s)。
解析:(1)自发反应,通常为放热反应,即H小于0。(2)以NO计算,2s内NO的浓度变化为(10-2.5)×10-4mol/L,V(NO)=7.5×10-4/2
=3.75×10-4mol/(L·s)。根据速率之比等于计量系数比可知,V(N2)=1/2 V(NO)=1.875×10-4mol/(L·s)。
(3)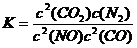 =
=
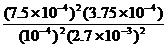 =5000。
=5000。
(4)催化剂不影响平衡的移动,A项错;该反应放热,故降温平衡正向移动,NO转化率增大,B项错,C项正确;缩小体积,即增大压强,平衡向体积减小的方向运动,即正向移动,D项正确。
(5)本题为实验探究题,目的是研究温度和催化剂的比表面积对速率的影响,研究时只能是一个变量在起作用,所以II中数据与I比较催化剂的比表面积增大了,故其他的数据应与I完全相同;III中数据与II比较,催化剂的比表面积数据未变,但是温度升高,故其他数据是不能改变的。实质I、II研究是催化剂的比表面积对速率的影响,II、III研究是温度对速率的影响。作图,可根据先拐先平的原则,即最里面的线先达平衡,速率快,应对应于III(因为其温度和催化剂的比表面积是三组中最高的),II比I快,因为两组温度相同,但是II中催化剂的比表面积大。
20. (09江苏卷
(09江苏卷 20)(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
20)(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
 (1)已知:2NO2(g)=====N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
(1)已知:2NO2(g)=====N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。
N2O4(g)达到平衡。
 其他条件不变时,下列措施能提高NO2转化率的是 (填字幕)
其他条件不变时,下列措施能提高NO2转化率的是 (填字幕)
 A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1
 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g)
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
 (4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2H4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2H4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
 答案:(1)BC
答案:(1)BC (2)-1224.96
(2)-1224.96
 (3)根据题意知平衡时:
(3)根据题意知平衡时: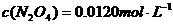 ;
; 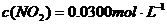
 K=
K=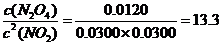
 答:平衡常数为13.3。
答:平衡常数为13.3。
 (4)由(3)可知,在17℃、1.01×105Pa达到平衡时,1.00L混合气体中:
(4)由(3)可知,在17℃、1.01×105Pa达到平衡时,1.00L混合气体中:

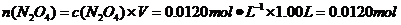

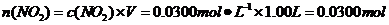
 则
则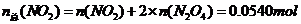
 由
由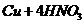 ===
===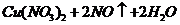 可得
可得

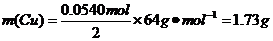
 答:理论上至少需消耗Cu 1.73 g.
答:理论上至少需消耗Cu 1.73 g.
 解析:(1)考查影响化学平衡移动的因素(2)简单的反应热计算要注意将质量转化为物质的量,还要注意比例关系。(3)(4)见答案
解析:(1)考查影响化学平衡移动的因素(2)简单的反应热计算要注意将质量转化为物质的量,还要注意比例关系。(3)(4)见答案
19.(09江苏卷 17)(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
17)(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
 (1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
 A.热裂解形成燃油
B.露天焚烧
A.热裂解形成燃油
B.露天焚烧
 C.作为有机复合建筑材料的原料
D.直接填埋
C.作为有机复合建筑材料的原料
D.直接填埋
 (2)用
(2)用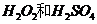 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:

 ====
====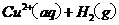
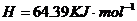

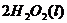 ====
====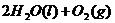
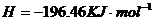

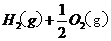 ====
==== 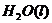
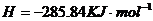
 在
在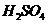 溶液中
溶液中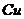 与
与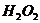 反应生成
反应生成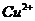 和
和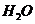 的热化学方程式为 。
的热化学方程式为 。
 (3)控制其他条件相同,印刷电路板的金属粉末用10℅
(3)控制其他条件相同,印刷电路板的金属粉末用10℅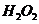 和3.0
和3.0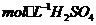 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
铜平均溶解速率 ( (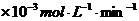 ) ) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
 (4)在提纯后的
(4)在提纯后的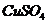 溶液中加入一定量的
溶液中加入一定量的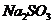 和
和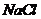 溶液,加热,生成
溶液,加热,生成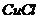 沉淀。制备
沉淀。制备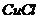 的离子方程式是
。
的离子方程式是
。

 答案: (1)BD
答案: (1)BD (2)Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
(2)Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
 (3)H2O2
分解速率加快
(3)H2O2
分解速率加快 (4)2Cu2++SO32-+2Cl-+H2O
(4)2Cu2++SO32-+2Cl-+H2O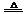 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
 解析:(1)有关环保的比较容易。(2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。(3)考察影响化学反应速率的因素,结合双氧水的性质即可得出答案。(4)根据题目条件书写离子方程式常规题。
解析:(1)有关环保的比较容易。(2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。(3)考察影响化学反应速率的因素,结合双氧水的性质即可得出答案。(4)根据题目条件书写离子方程式常规题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com