
5. (09广东化学 9)下列浓度关系正确的是
9)下列浓度关系正确的是
 A. 氯水中:c(Cl2)=2[c(
A. 氯水中:c(Cl2)=2[c(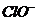 )+c(
)+c(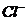 )+C(HClO)]
)+C(HClO)]
 B. 氯水中:c(
B. 氯水中:c(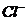 )>c(
)>c(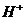 )>c(
)>c(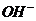 )>c(
)>c(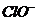 )
)
 C. 等体积等浓度的氢氧化钠与醋酸混合:c(
C. 等体积等浓度的氢氧化钠与醋酸混合:c(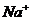 )=c(
)=c(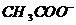 )
)
 D.
D. 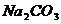 溶液中:c
溶液中:c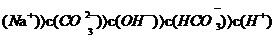
 答案:D
答案:D
 解析:
解析:
根据氯水中所含粒子的种类可知氯水中也含有氯气分子A设置了一个貌似物料守恒的式子而忽视了氯气分子的存在,故A错;
根据Cl2+H2O HClO+H++Cl-,HCl完全电离 而HClO部分电离,可知正确的顺序c(H+)>c(Cl-)>c(ClO-)>c(OH-),B错;
HClO+H++Cl-,HCl完全电离 而HClO部分电离,可知正确的顺序c(H+)>c(Cl-)>c(ClO-)>c(OH-),B错;
C项等物资的量的强碱与弱酸混合生成强碱弱酸盐溶液显碱性c(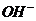 )>c(
)>c(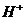 ),再根据溶液中电荷守恒可以判断c(
),再根据溶液中电荷守恒可以判断c(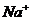 )>c(
)>c(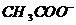 ;
;
D项比较简单
4.(09江苏卷 14)I2在KI溶液中存在下列平衡:
14)I2在KI溶液中存在下列平衡:

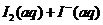

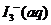
 某I2、、KI混合溶液中,
某I2、、KI混合溶液中,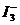 的物质的量浓度c(
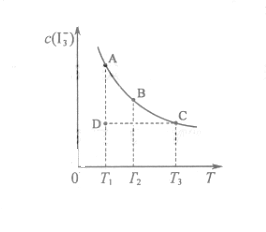
的物质的量浓度c(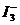 )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是

A. 反应
反应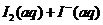

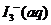 的△H>0
的△H>0
 B.若温度为
B.若温度为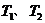 ,反应的平衡常数分别为
,反应的平衡常数分别为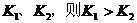
 C.若反应进行到状态D时,一定有
C.若反应进行到状态D时,一定有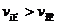
 D.状态A与状态B相比,状态A的c(I2)大
D.状态A与状态B相比,状态A的c(I2)大
答案:BC
解析:
随着温度的不断升高,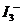 的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以
的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以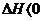 ,所以A项错;
,所以A项错;
因为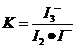 ,
,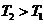 ,所以当温度升高时,反应向逆方向移动,即
,所以当温度升高时,反应向逆方向移动,即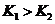 ;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时
;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时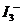 的浓度在增加,所以
的浓度在增加,所以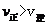 ,C项正确;
,C项正确;
D项,从状态A到状态B,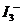 的浓度在减小,那么
的浓度在减小,那么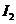 的浓度就在增加。
的浓度就在增加。
3.(09江苏卷 11) 下列离子方程式与所述事实相符且正确的是
11) 下列离子方程式与所述事实相符且正确的是
 A.漂白粉溶液在空气中失效:
A.漂白粉溶液在空气中失效: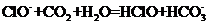
 B.用浓盐酸与
B.用浓盐酸与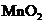 反应制取少量氯气:
反应制取少量氯气: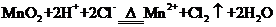
 C.向
C.向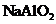 溶液中通入过量
溶液中通入过量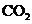 制
制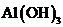 :
:

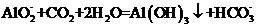
 D.在强碱溶液中次氯酸钠与
D.在强碱溶液中次氯酸钠与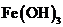 反应生成
反应生成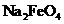 :
:

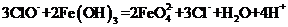
答案:C
解析:
漂白粉失效的化学方程式为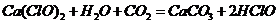 ,那么该反应的离子方程式是
,那么该反应的离子方程式是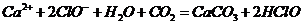 ,A项错;实验室制取
,A项错;实验室制取 的原理是浓盐酸和二氧化锰反应,离子方程式为
的原理是浓盐酸和二氧化锰反应,离子方程式为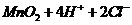

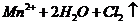 ,所以B项错;D项,在强碱溶液中,不可能生成
,所以B项错;D项,在强碱溶液中,不可能生成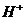 ,所以D错。
,所以D错。
2.(09天津卷 3)下列实验设计和结论相符的是
3)下列实验设计和结论相符的是
 A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
 B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
 C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
 D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
答案:B
解析:
A项,乙醇不可以作为萃取剂,错;
B项,石蕊变蓝,则肯定为碱性,正确。
C项,若原溶液中含有SO32 -,生成BaSO3,再加入HCl,则与溶液的NO3- 结合,相当于HNO3,则可以氧化BaSO3至BaSO4,沉淀不溶解,故错;
D项,加热时,FeCl3会水解,错。
1.(09全国卷Ⅱ
 13) 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
13) 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是

 A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-

 B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-

 C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-

 D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
答案:B
解析:
由于Fe2+的还原性强于Br-,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化Br-。2Fe2+ + Cl2
 2Fe3+ +
2Cl-,2Br- + Cl2
2Fe3+ +
2Cl-,2Br- + Cl2  Br2 + 2Cl-,2FeBr2 + 3Cl2
Br2 + 2Cl-,2FeBr2 + 3Cl2  2FeCl3 + 2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确。当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
2FeCl3 + 2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确。当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
10.(09北京卷27)(14分)某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将 氧化成
氧化成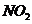 ,而稀硝酸不能氧化
,而稀硝酸不能氧化 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
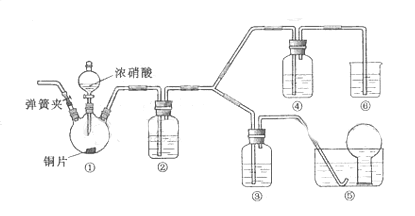
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与 反应,能与
反应,能与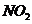 反应
反应
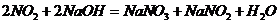
(1) 实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(2) 滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(3) 装置①中发生反应的化学方程式是
(4) 装置②的作用是 ,发生反应的化学方程式是
(5) 该小组得出的结论依据的试验现象是
(6) 试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a. 加热该绿色溶液,观察颜色变化
b. 加水稀释绿色溶液,观察颜色变化
c. 向该绿色溶液中通入氮气,观察颜色变化
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
9. (09全国卷Ⅰ29)(15分)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是
;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
。
答案:
(1)原子晶体。
(2)NO2和N2O4
(3)As2S5。
(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
 解析:
解析:
本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。
(1)SiO2为原子晶体。
(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。
(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。R为As,所以R的最高价化合物应为As2S5。
(4)显然x为P元素。①氢化物沸点顺序为NH3> AsH3 > PH3,因为前者中含有氢键后两者构型相同,分子间作用力不同。②SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。
(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
8.(09宁夏卷7) 将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
A.NO2 B.N2O2 C.N2O D.N2O4
答案:A
 解析:
解析:
根据2NxOy+2yCu=2yCuO+xN2,以及题中数据反应后气体体积为反应前气体体积的一半,可以得到x=1,因此只有A选项符合题意。
7.(09上海卷 20)对于常温下pH为1的硝酸溶液,下列叙述正确的是
20)对于常温下pH为1的硝酸溶液,下列叙述正确的是
 A.该溶液lmL稀释至100mL后,pH等于3
A.该溶液lmL稀释至100mL后,pH等于3
 B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
 C.该溶液中硝酸电离出的
C.该溶液中硝酸电离出的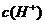 与水电离出的
与水电离出的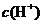 之比值为
之比值为 。
。
 D.该溶液中水电离出的
D.该溶液中水电离出的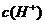 是pH为3的硝酸中水电离出的
是pH为3的硝酸中水电离出的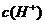 的100倍
的100倍
答案:AB
6.(09上海卷 7)在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
7)在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
 A.①②③ B.②①③ C.③②① D.③①②
A.①②③ B.②①③ C.③②① D.③①②
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com