
37. (09年宁夏理综·28)(14分)2SO2(g)+O2(g)
(09年宁夏理综·28)(14分)2SO2(g)+O2(g)
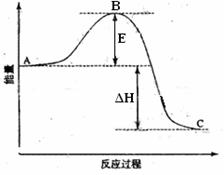
 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)= mol·L-1·min-1、v(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
答案:(1)反应物能量 生成物能量 (2)无 降低 因为催化剂改变了反应的历程使活化能E降低 (3)-198 (4)SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5 (4)0.025 0.05
(5)S(s)+O2(g)
=2SO2(g)△H1=-296
KJ·mol-1 , SO2(g)+1/2O2(g)  SO3(g)
△H2=-99
KJ·mol-1
SO3(g)
△H2=-99
KJ·mol-1
3S(s)+9/2O2(g)=3SO3(g) △H=3(△H1+△H2)=-1185 KJ·mol-1
36.(09年山东理综·28)(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-
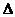 H1=1175.7
kJ·mol-1
H1=1175.7
kJ·mol-1
PtF6(g)+e-=PtF6-(g)
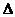 H2=-771.1
kJ·mol-1
H2=-771.1
kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)
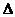 H3=482.2
kJ·mol-1
H3=482.2
kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 H=_____________
kJ·mol-1。
H=_____________
kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4*)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
答案:(1)向左 不改变
(2)-77.6
(3)Cu(OH)2 Cu2++2NH3·H2O = Cu(OH)2↓ +2NH4+
(4)中 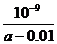 mol·L-1
mol·L-1
35. (09年上海化学·24)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(09年上海化学·24)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
 (1)已知KBrO3在反应中得到电子,则该反应的还原剂是
。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
。
 (2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为
。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为
。
 (3)根据上述反应可推知
。
(3)根据上述反应可推知
。
 a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
 c.还原性:AsH3>X
d.还原性:X>AsH3
c.还原性:AsH3>X
d.还原性:X>AsH3
 (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
 向和数目:
向和数目:

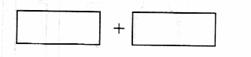
答案:(本题共8分)
 (1)AsH3
(1)AsH3
 (2)Br2
(2)Br2
 (3)a c
(3)a c
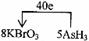
 (4)
(4)
34.(09年重庆理综·12)下列热化学方程式数学正确的是(△H的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g);△H=-269.8kJ/mol(反应热)
D. 2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
答案:C
33.(09年重庆理综·8)下列各组离子,能在溶液中大量共存的是
A.Na+、Mg2+、AlO2-、Br- B.H+、Fe2+、SO42-、NO3-
C.K+、NH4+、CO32-、OH- D.Ca2+、Al3+、NO3-、Cl-
答案:D
31.(09年四川理综·11)向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A.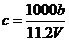 B.
B.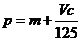
C.n=m+17Vc D.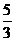 <p<
<p<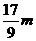
答案:C
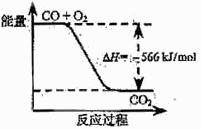
32 .(09年天津理综·6)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
.(09年天津理综·6)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
 Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+
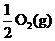 ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
 根据以上热化学方程式判断,下列说法正确的是
根据以上热化学方程式判断,下列说法正确的是
 A.CO的燃烧热为283 kJ
A.CO的燃烧热为283 kJ
 B.右图可表示由CO生成CO2的反应过程和能量关系
B.右图可表示由CO生成CO2的反应过程和能量关系
 C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452
kJ/mol
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452
kJ/mol
 D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
答案:C
30.(09年四川理综·9)25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1) △H=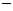 57.3 kJ/mol
57.3 kJ/mol
B.KOH(aq)+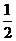 H2 SO4(aq)=
H2 SO4(aq)=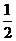 K2SO4(aq)+H2O(l) △H=
K2SO4(aq)+H2O(l) △H=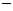 57.3kJ/mol
57.3kJ/mol
C.C8H18(I)+ O2(g)=8CO2(g)+9H2O △H=
O2(g)=8CO2(g)+9H2O △H=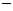 5518 kJ/mol
5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1) △H=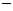 5518 kJ/mol
5518 kJ/mol
答案:B
29.(09年四川理综·8)在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.FeCl2溶液:K+、、Na+、、SO42-、、AlO2-
D.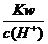 =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
答案:D
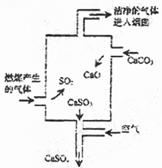
28.(09年上海理综·15)右图是某燃煤发电厂处理废气的装置示意图。装置内发生的主要反应中不含
A.化合反应 B.分解反应
C.置换反应 D.氧化还原反应
答案:C
27.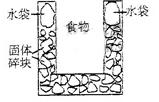 (09年上海理综·10)右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
(09年上海理综·10)右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
A.硝酸铵 B.生石灰
C.氯化镁 D.食盐
 答案:B
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com